
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зажигание
|
|
|
|
Цепное самовоспламенение (цепной взрыв).
По теории Аррениуса скорость химической реакций определяется чис-лом молекул, обладающей энергией активации. Однако саморазогрев горю-чей смеси при экзотермической реакции из-за недостаточного теплоотвода (по тепловой теорий самовоспламенения) – не единственно возможный ме-ханизм ускорения реакций.
Тепловая теория не в состоянии объяснить ряд особенностей горения, как, например, катализ и ингибирование при введении в реагирующую смесь малых добавок некоторых веществ (воды, галоидоводородов и т.п.), светохи-мические реакции (Н2+Cl2) и т.д. Эти явления объясняются цепной теорией самовоспламенения, в соответствии с которой химическая реакция самоуско-ряется не путем непосредственного взаимодействия исходных молекул с вы-делением тепла, а с помощью активных "осколков" (радикалов, атомарных частиц и др.), образующихся при распаде этих молекул. При этом скорость реакций может прогрессивно возрастать и в изотермических условиях.
Таким образом, причиной самоускорения реакций может быть накоп-ление в системе как тепла реакции, так и химически активных продуктов ре-акции.
По тепловому механизму после химического взаимодействия продукты реакции обладают большим запасом кинетической энергии. Эта энергия мо-жет рассеиваться в окружающем пространстве при соударениях молекул или излучением, а также расходоваться на разогрев реагирующей смеси.
Цепной механизм реакции объясняется перераспределением избыточ-ной энергии, которая реализуется в реакции следующим образом: запас хи-мической энергии, сосредоточенный в молекуле продукта первичной реак-ции, передается одной из реагирующих молекул, которая переходит в хими-чески активное состояние. Подобные условия более благоприятны для про-текания реакции, чем условия, при которых химическая энергия взаимодей-ствия переходит в энергию теплового хаотического движения.
При таком механизме передачи энергии реакция приводит к образова-нию одной или нескольких новых активных частиц – возбужденных молекул, свободных радикалов или атомов. Таковы, например, атомарный водород, кислород, хлор, радикалы и гидроксил, и т.д. Все эти вещества, являясь хи-мически ненасыщенными, отличаются высокой реакционной способностью и могут реагировать с компонентами смеси, образуя в свою очередь, свобод-ные радикалы и атомы. Так образуется цепочка последовательных реакций.
Цепная реакция протекает различно, в зависимости от того, сколько ак-тивных вторичных центров образуется на каждый израсходованный актив-ный центр – один или больше одного. В первом случае общее число актив-ных центров остается неизменным, и реакция протекает с постоянной (при данных температуре и концентрации) скоростью, т.е. стационарно. Во вто-ром случае число активных центров непрерывно возрастает, цепь разветвляя-ется и реакция самоускоряется.
Это неограниченное, до полного израсходования реагирующих компо-нентов, самоускорение воспринимается как самовоспламенение. Внешне ре-акция протекает так же, как и при тепловом самовоспламенении. Различие состоит в том, что при тепловом механизме в реагирующей смеси накаплива-ется тепло, а при цепном механизме – активные центры. Оба фактора ведут к ускорению реакции. Цепное воспламенение принципиально может осущес-твляться при постоянной температуре без заметного разогрева смеси.
Типичным примером цепной разветвленной реакции является процесс окисления водорода (взрыв гремучего газа).
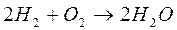
Реакция протекает по схеме:
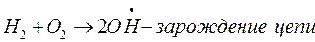
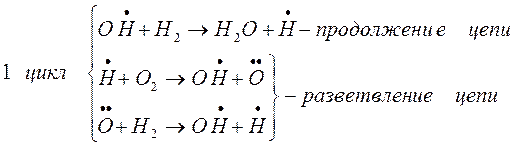
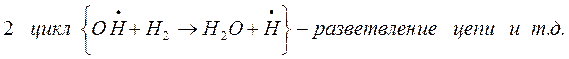
Разветвление цепи проходит при следующих реакциях:
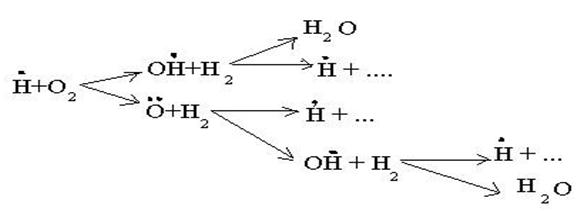
когда за один цикл превращений каждый вступающий в реакцию атом водо-рода вызывает образование двух молекул воды и трех новых атомов водоро-да.
Обрыв цепей проходит либо на стенке:
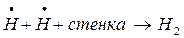 ,
,
либо в объеме: 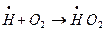 с образованием малоактивного радикала НО2.
с образованием малоактивного радикала НО2.
Причинами обрыва цепи в объеме смеси является:
1) побочная реакция активного центра с примесями, содержащимися в смеси;
2) рассеивание активной частицей избыточной химической энергии при столкновениях с неактивными молекулами.
Обрыв цепи на стенках реакционного сосуда объясняется адсорбцией активных центров на его поверхности.
Условием ускорения реакции является в данном случае превышение числа разветвления цепей над числом их обрывов. Цепные реакции могут протекать и при полном отводе тепла, т.е. в изотермических условиях, тогда как при тепловом механизме реакция должна была бы затухнуть. По цепной теории появление тепла – только следствие процесса, а не причина возникно-вения горения.
Зажигание – это процесс инициирования начального очага горения в горючей смеси за счет ввода в смесь извне высокотемпературного источника тепловой энергии. Происхождение источника зажигания может быть различ-ным. Его высокая температура может быть следствием нагрева (накаленное тело), химической реакции (пламя, тепловые жиры), электрического разряда (электрические и электростатические искры), механического трения (зажига-ние спички, искры при заточке инструмента) или соударения (кремень) твер-дых тел.
Поджигание заключается в быстром локальном разогреве горючей сме-си, который приводит к резкому протеканию реакции в разогретом объеме. Зажигание при контакте с накаленной поверхностью происходит, если тем-пература этой поверхности превышает некоторое предельное значение, назы-ваемое температурой зажигания.
Рассмотрим схему теплового воспламенения по Вант-Гоффу (рис. 25):

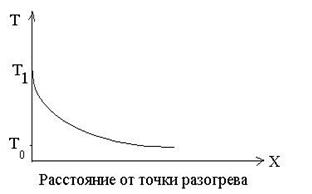 г Рис. 25. Распространение тепла от
г Рис. 25. Распространение тепла от
источника поджигания:
а) В инертной среде: в данном случае
теплота просто отводится в холодную
инертную среду с температурой Т0;
 |

 г
г
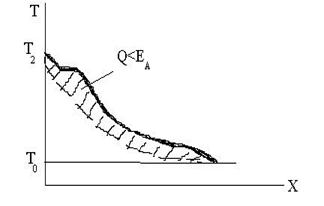
б) В среде, способной к экзотермиче-
ской реакции, но Т2 недостаточна для
возникновения прогрессивного про-
цесса разогрева и самоускорения ре-
акции, т.е. принесенная энергия мень-
ше энергии активации.

 г
г
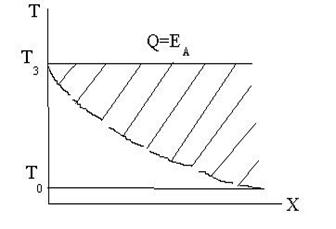
в) В горючей смеси, когда Т3 доста-
точна для самоускорения реакции и
воспламенения, т.е. внесенная энергия
равна энергии активации. При этих ус-
ловиях формируется очаг горения.
Т3=Тзажигания – предел определяющий
область воспламенения от медленно
затухающей реакции.
 г
г
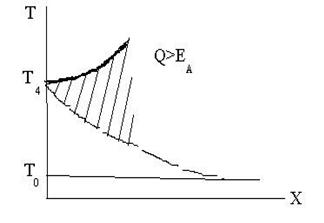 г) В горючей смеси, когда Т4>Тзажигания. Скорость реакции крайне быстро воз-растает, самоускоряется и приводит к взрыву.
г) В горючей смеси, когда Т4>Тзажигания. Скорость реакции крайне быстро воз-растает, самоускоряется и приводит к взрыву.
Температура зажигания горючей смеси всегда выше температуры само-воспламенения. Это обусловлено разными условиями теплоотвода из зоны реакции: при самовоспламенении смесь окружена высоконагретыми стенка-ми, а при зажигании – холодными.
Однако не всякий высокотемпературный источник вызывает в горючей смеси очаг пламени. Пламя появляется лишь в том случае, если энергия, вы-деляющаяся из источника превышает некоторую величину, называемую ми-нимальной энергией зажигания.
Энергии зажигания должно быть достаточно для создания устойчивого горения, т.е. передачи тепла от горящих первых слоев горючей смеси исход-ным слоям, и повышение температуры до температуры горения Тг.
При температуре горения создается стационарный самоподдерживаю-щийся режим распространения пламени, т.е. процесс горения.
Тема 7. РАСПРОСТРАНЕНИЕ ПЛАМЕНИ.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 408; Нарушение авторских прав?; Мы поможем в написании вашей работы!