
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомные орбитали. Квантовые числа
|
|
|
|
Орбиталь (электронное облако) – это наиболее вероятное местонахождение электрона в каком-то объёме околоядерного пространства. За пределами этого пространства вероятность встретить электрон достаточно мала (менее 5%). Для описания орбиталей используются три квантовых числа n, l, ml.
5.1. Главное квантовое число n. В атоме водорода существуют стационарные орбиты, вращаясь по которым электрон не излучает и не поглощает энергию. Н. Бор рассчитал радиусы стационарных орбит с помощью главного квантового числа. n – главное квантовое число, n = 1,2,3,4,...+ ∞. n определяет размер электронного облака и его энергетический запас.Вращаясь по стационарным орбитам, электроны обладают определённым запасом потенциальной энергии. По мере удаления от ядра потенциальная энергия электронов возрастает. Стационарные орбиты называются энергетическими уровнями.
Главное квантовое число имеет две функции:
5.2. l – орбитальное квантовое число. Оно отвечает значению орбитального момента количества движения электрона, тесно связано с главным и принимает значения 0…(n-1). Для s-подуровня l=0; для р-подуровня – l=1; для d-подуровня – l=2 и т.д.;Орбитальное квантовое число характеризует энергетические подуровни в электронной оболочке атома, определяет конфигурацию подуровней. Согласно квантовомеханическим расчётам S-орбитали имеют форму шара, p-орбитали - форму гантели, d- и f-орбитали - более сложные формы.На одном уровне энергия подуровней возрастает в ряду:
ES < E p< Ed< Ef.
5.3. Магнитное квантовое число mI . В атоме возникают магнитные поля, которые ориентируют подуровни в пространстве строго определённым образом. Магнитное квантовое число принимает значение целых чисел: -l...0...+l.
| значение l | значение mI | количество орбиталей |
| 0(S) | ||
| 1(p) | -1,0,+1 | |
| 2(d) | -2, -1,0,+1+2 | |
| 3(f) | -3,-2,-1,0,+1+2 +3 |
5.4.. Четвёртое квантовое число - спиновое - описывает собственный момент количества движения электрона и принимает значения: m s = ± 1/2. Электроны могут вращаться только в двух взаимопротивоположных направлениях, условно обозначаемых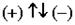 .
.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 721; Нарушение авторских прав?; Мы поможем в написании вашей работы!