
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок заполнения атомных орбиталей
|
|
|
|
Законы, определяющие положение электронов в атоме
6.1.. Любая частица стремится к минимальному запасу потенциальной энергии.
6.2. Запрет Паули. В атоме не может быть двух электронов, имеющих одинаковые значения всех четырёх квантовых чисел. Запрет Паули определяет электронную ёмкость орбиталей, подуровней и уровней. Электронная ёмкость уровней рассчитывается по формуле:N = 2n2, где N – число электронов на данном уровне, n – главное квантовое число.
6.3. Принцип Хунда На данном энергетическом подуровне электроны располагаются таким образом, чтобы модуль их суммарного спина был максимальным.
6.4. Первый закон Клечковского. Электронами в первую очередь заполняются орбитали с меньшим значением суммы главного и орбитального чисел, а затем уже орбитали с большим значением суммы этих двух чисел. Согласно первому закону Клечковского, в первую очередь заполняются электронами nS-орбитали, а затем (n-1)d, которые имеют больший запас потенциальной энергии.
6.5. Второй закон Клечковского. Если две орбитали имеют одинаковое значение суммы главного и орбитального чисел, то в первую очередь электронами заполняется та орбиталь, у которой главное квантовое число имеет меньшее значение.
Заполнение электронами энергетических уровней и подуровней происходит в соответствии с принципом минимальной энергии, правилами Гунда и Клечковского:
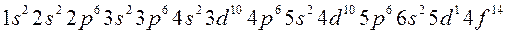
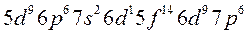 (2.3):
(2.3):
Пример 1. Напишите электронную формулу элемента Al и иона Al3+.Какие значения квантовых чисел n, l, m l, m s имеют валентные электроны атома 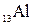 ?
?
Решение. 1. Электронную формулу атома алюминия составим согласно формуле (2.3):
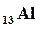
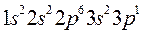 .
.
Ион Al3+ имеет на три электрона меньше. чем нейтральный атом. При образовании иона в данном случае уходят электроны с внешнего третьего уровня. Таким образом, электронная формула иона алюминия будет выглядеть следующим образом: Al3+: 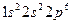 .
.
2. Известно, что валентными для s и p- элементов являются электроны внешнего слоя. Для атома алюминия это 3s23p1.
Состояние электрона в атоме описывается набором четырех квантовых чисел в виде групп символов nlx:
а) n- главное квантовое число, определяется по номеру заполненного уровня;
б) l- побочное (орбитальное) квантовое число. Для s-подуровня l=0; для р-подуровня – l=1; для d-подуровня – l=2 и т.д.; х - число электронов на этом подуровне;
в) m l – магнитное квантовое число, принимающее следующие значения: 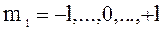 ;
;
г) m s - спиновое квантовое число, принимающее значения ±1/2.
Для определения квантовых чисел необходимо распределить валентные электроны по квантовым ячейкам: 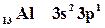
| 13 Al | 3s2 | 3p1 | |||||||
| ¯ | | ||||||||
| n= | 3 3 |
-1
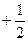
| |||||||
| l= | 0 0 | ||||||||
| ml = ms= | 0 0
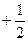 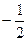
| ||||||||
8.Упражнения для самоконтроля направлены на закрепление следующих понятий:
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 998; Нарушение авторских прав?; Мы поможем в написании вашей работы!