
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Составление уравнений химических реакций
|
|
|
|
Составление химических формул соединений
Упражнения:
1. Атом, какого элемента имеет наибольший радиус?
а) С б) В в) О г) F
- У какого из перечисленных элементов наибольшее сродство к электрону?
а) О б) S в) Se г) Те
- Какой из гидроксидов проявляет наиболее сильные основные свойства?
а)Be(OH)2 б)LiOH в)Mg(OH)2 г)NaOH - Для какого элемента справедливо уравнение реакции:
ЭО3 + Н2О ↔ Н2ЭО4
i. а) Р б) I в) С г) S
- С какими из ниже перечисленных веществ будет реагировать серная кислота, Напишите уравнения реакций: 1) SO2, 2)ZnO, 3)Mg, 4) Ba(OH)2, 5) HCl, 6) Fe2O3, 7) P2O5
i. Ответы: 1 - б) В; 2 - а) О; 3 - г)NaOH; 4 - г) S; 5 -2)ZnO, 3)Mg, 4) Ba(OH)2,, 7) Fe2O3.
Уравнения реакций:
2)ZnO + H2SO4 = Zn SO4 + H2О
3)Mg+ H2SO4 = Mg SO4 + H2
4) Ba(OH)2+ H2SO4 = ВаSO4 + 2H2О
7) Fe2O3+ 3H2SO4 = Fe2 (SO4)3+ 3H2О
Лекция 4. Химическая связь
Основные виды химической связи. Ковалентная связь и ее свойства. Ионная связь и ее свойства. Водородная связь и ее свойства. Комплементарность. Металлическая связь и ее свойства.
4.1. Основные виды химической связи. Под химической связью понимают результат взаимодействия двух и более атомов, приводящий к образованию устойчивой многоатомной системы.
Важнейшими видами химической связи являются: ковалентная, ионная водородная, металлическая, межмолекулярная.
4.2. Ковалентная связь и ее свойства.
Ковалентная связь является наиболее универсальной в том плане, что ей подчиняется подавляющее большинство веществ как органических, так и неорганических. Суть ковалентной связи по методу валентных связей (ВС) заключается в том, что атомы, объединяя свои неспаренные валентные электроны с антипараллельными спинами в общую электронную пару, образуют более сложную частицу.
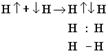 .
.
Электронную пару по методу ВС обозначают двумя точками или чёрточкой - валентным штрихом. Ковалентная связь имеет пять основных свойств:
1. Энергия связи – выделенная атомами потенциальная энергия при образовании ими более сложных частиц.
При сближении двух атомов водорода максимально выделяется 435 кДж/моль. Это и является энергией молекулы водорода. Такой энергии соответствует максимально прочная молекула водорода. Энергия ковалентной связи лежит в пределах 150 ÷ 1000 кДж/моль. Чем выше энергия, тем прочнее частица.
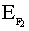 =150кДж/моль
=150кДж/моль
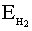 =435кДж/моль
=435кДж/моль
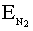 = 970 кДж/моль.
= 970 кДж/моль.
2. Длина связи – расстояние между центрами двух атомов, которое соответствует максимально потерянной потенциальной энергии, и сложная частица является наиболее прочной. Таким образом, длина связи тесно связана с энергией. Для атома водорода длина связи составляет 0,74 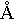 . Это означает, что два атома Н2 не просто соприкасаются, а частично перекрывают друг друга. Область перекрытия показывает место нахождения общей электронной пары и называется областью повышенной электрической плотности.
. Это означает, что два атома Н2 не просто соприкасаются, а частично перекрывают друг друга. Область перекрытия показывает место нахождения общей электронной пары и называется областью повышенной электрической плотности.
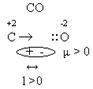
3. Полярность. Ковалентные частицы могут быть полярными и неполярными. Полярная ковалентная связь возникает в том случае, если частица образованна атомами с различными электроотрицательностями. В молекуле возникают два поля – диполи (+; -), между которыми есть какое-то расстояние. Диполь определяется дипольным моментом, который равен заряду электрона, умноженному на дипольное расстояние: μ = е • l. Размерность дипольного момента Кулон/метр (Кл/м). Чем больше разница между электроотрицательностью элементов, тем больше дипольный момент сложной частицы, т.е. тем полярней диполь. Неполярная ковалентная связь возникает в том случае, если частица образуется атомами с одинаковой электроотрицательностью. В ковалентных неполярных частицах общая электронная пара принадлежит одинаково ядрам обоих атомов.Расстояние между "+" и "–" равно нулю. Дипольный момент тоже равен нулю. Полярность связи и полярность частиц не всегда совпадают между собой.
| 
| 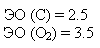
|
Полярность – векторная величина. Вектор всегда направлен от менее электроотрицательных элементов к более электроотрицательным элементам.
В молекуле СО2 два вектора, равные по величине, но противоположные по направлению, компенсируют друг друга, и молекула оказывается неполярной при полярной связи.
4. Насыщаемость ковалентной связи заключается в том, что все неспаренные валентные электроны обязаны участвовать в образовании сложных частиц.
5. Направлентность ковалентной связи заключается в том, что ковалентные частицы имеют определённую пространственную конфигурацию.
Пространственная конфигурация отдельной частицы определяется количеством σ – связей и их взаимным расположением в пространстве.
σ- связями называются связи, у которых область повышенной электрической плотности располагается на линии, связывающей ядра двух атомов.
σ – связь - это первичная связь. Она является прочной и трудно разрывается. π – связью называется та связь, при которой обе повышенные электрические плотности располагаются выше и ниже линии, связывающей ядра двух атомов. π – связь всегда вторична и менее прочна, чем σ – связь. При образовании молекулы водорода перекрываются 2S – облака, и образуется одна σ – связь. Возникает линейная молекула с нулевым валентным углом.
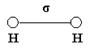
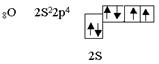
Такие же частицы, т.е. линейные с нулевым валентным углом, образуются при перекрывании двух рх – облаков, при образовании, например, молекул хлора или фтора. Такие же частицы образуются при перекрывании S- и p-облаков (например, HCl). Рассмотрим элемент шестой группы таблицы Менделеева - кислород.
 .
.
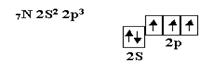
Кислород является центральным атомом в молекуле воды. Из шести валентных электронов атомов кислорода - два неспаренных. в пространстве возникают две σ–связи, расположенные друг к другу под теоретическим углом 90°. В молекуле воды угол равен 105°, но это вызывается дополнительными причинами. Азот, элемент пятой группы таблицы, имеет следующее валентное окончание:
 .
.
Атом азота имеет три неспаренных электрона, которые участвовуют в образовании частиц, например, NH3.Три σ – связи, расположенные под углом 90° по отношению друг к другу, приводят к образованию молекулы, имеющей форму треугольной пирамиды с валентными углами 90° Углерод, элемент четвёртой группы таблицы, в возбуждённом состоянии имеет четыре неспаренных электрона и проявляет валентность, равную четырём
 .
.
Электроны, находящиеся в S- и в p-состояниях, не равноценны между собой, так как имеют разную конфигурацию и различный запас потенциальной энергии. Чтобы образовать равноценные связи, эти электроны должны гибридизироваться. Гибридизация электронов происходит по форме и энергии. S- и р – облака образуют гибридные – облака В атоме углерода происходит SP3 – гибридизация, которая приводит к образованию четырёх гибридных q – электронов: SP3  q4.
q4.
Четыре равноценных q – электрона образуют четыре равноценные σ – связи, например, в молекуле метана CH4. Такие молекулы (CH4, CCl4 и т.д.) имеют пространственную конфигурацию - тетраэдр с валентными углами 109°28'.
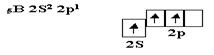
Бор, элемент третьей группы таблицы Менделеева, имеет вапентное окончание:
 .
.
В молекуле BCl3 все три связи должны быть образованы равноценными электродами, поэтому валентные электроны атома бора подвергаются гибридизации. В данном случае, SP2 -гибридизации, в результате которой образуются три гибридных q-электрона.
SP2  q3
q3
Молекула BCl3 имеет в пространстве конфигурацию плоского треугольника с валентными углами120°.
Элемент второй группы, бериллий, образует сложные частицы только в возбуждённом состоянии:
 .
.
Валентные электроны атома бериллия подвергаются Sp – гибридизации, в результате которой образуется два гибридных q – электрона.
SP q2
q2
Два гибридных q – электрона, перекрываясь, образуют две σ – связи.
В результате образуется линейная молекула с валентным углом 180°.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 593; Нарушение авторских прав?; Мы поможем в написании вашей работы!