
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродные потенциалы активных и пассивных металлов
|
|
|
|
Окислительно-восстановительные реакции. Понятие об электродных потенциалах. Гальванические элементы, ЭДС и ее измерение. Стандартный водородный электрод и водородная шкала потенциалов. Уравнение Нернста. Потенциалы металлических, газовых и окислительно-восстановительных электродов. Концентрационные и топливные гальванические элементы.
Лекция 14. Окислительно-восстановительные процессы
- 14.1. Окислительно-восстановительные реакции Окислительно-восстановительными называются реакции, которые сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ. Атом элемента в высшей степени окисления является только окислителем (например, сера в молекуле H2SO4 имеет высшую степень окисления 6+); атом элемента в низшей степени окисления является только восстановителем (например, сера в молекуле H2S имеет низшую степень окисления 2-); атом элемента находящийся в промежуточной степени окисления может быть и окислителем и восстановителем (например, сера в молекуле H2SO3 имеет промежуточную степень окисления 4-). Такие соединения проявляют окислительно-восстановительную двойственность и способны к реакциям диспропорционирования.
Пример 1. Завершить уравнение реакции, дописав недостающие продукты. Составить уравнения полуреакций окисления и восстановления, на их основе написать уравнения реакций в ионной и молекулярной формах:
KNO2+KI+H2SO4®J2+NO + …`
Решение. В реакции иод меняет степень окисления от -1 в иодиде калия до нуля в I2. Иод теряет электроны, т.е. окисляется. Восстанавливаться в данной реакции будет азот, который меняет степень окисления от +3 до +2. Нитрит–ион восстанавливается до NO с приобретением одного электрона на каждый атом азота. Избыточный кислород нитрит-иона будет связываться водородными ионами кислой среды с образованием воды:
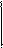
 |
Полученное уравнение является уравнением искомой реакции в ионной форме. Молекулярное уравнение реакции получится, если учесть, что ионы калия, освобождающиеся при разрушении молекул KNO2 и KJ образуют соли с серной кислотой: 2KNO2+2KI+2H2SO4®J2+2NO +2 К2SO4+2 H2O.
 14.2. Понятие об электродных потенциалах. Общие свойства металлов: электропроводность, теплопроводность, пластичность,- обусловлены типом химической связи в металлах, которая так и называется металлическая связь. Суть металлической связи заключается в том, что часть атомов в металле теряет свои валентные электроны, превращаясь в ионы.
14.2. Понятие об электродных потенциалах. Общие свойства металлов: электропроводность, теплопроводность, пластичность,- обусловлены типом химической связи в металлах, которая так и называется металлическая связь. Суть металлической связи заключается в том, что часть атомов в металле теряет свои валентные электроны, превращаясь в ионы.
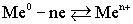
Таким образом, в узлах кристаллической решетки любого металла располагаются как нейтральные атомы, так и положительные ионы. Потерянные электроны располагаются в междоузлиях, образуя так называемый коллективный электронный газ. Ионы металла, располагающиеся на его границе, гидратируются молекулами воды:.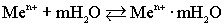 ,Под влиянием всевозможных видов движения гидратированные ионы отрываются от металла и уходят в воду:
,Под влиянием всевозможных видов движения гидратированные ионы отрываются от металла и уходят в воду: 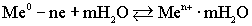 .На границе металла и воды возникает двойной электрический слой, т.е. скачок потенциала Up,В, который называется равновесным электродным потенциалом. Знак потенциала определяется по заряду металла. Количество ионов металла, содержащихся в литре насыщенного раствора, называется растворимостью металла. По величине растворимости металлы подразделяются на:активные и пассивныe.
.На границе металла и воды возникает двойной электрический слой, т.е. скачок потенциала Up,В, который называется равновесным электродным потенциалом. Знак потенциала определяется по заряду металла. Количество ионов металла, содержащихся в литре насыщенного раствора, называется растворимостью металла. По величине растворимости металлы подразделяются на:активные и пассивныe.
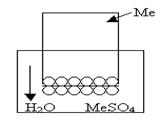 Рис.1 Рис.1
| Рассмотрим систему, в которой металл помещён в солевой раствор, рис1. Например, цинк, помещённый в раствор сульфата цинка. |
К активным металлам относится те, мера растворимости которых больше концентрации солевых растворов, принятых в электрохимии.
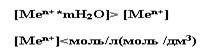 Если металл является активным, то равновесие обратимой реакции смещено в прямом направлении, т.е. в сторону окисления:
Если металл является активным, то равновесие обратимой реакции смещено в прямом направлении, т.е. в сторону окисления: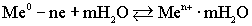 Возникающий электродный потенциал имеет знак "-".
Возникающий электродный потенциал имеет знак "-".
Пассивные металлы те, у которых величина растворимости меньше принятой в электрохимии концентрации солевых растворов.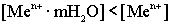 В данном случае равновесие реакции смещено в обратном направлении, т.е. в сторону восстановления. Возникающий электрический потенциал имеет знак "+".
В данном случае равновесие реакции смещено в обратном направлении, т.е. в сторону восстановления. Возникающий электрический потенциал имеет знак "+".
14.3.Величина равновесного электродного потенциала Нернст установил эту величину
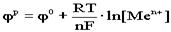 , где φ0 – стандартный электродный потенциал, т.е. потенциал, возникающий при нормальных условиях,
, где φ0 – стандартный электродный потенциал, т.е. потенциал, возникающий при нормальных условиях,
R - универсальная газовая постоянная,
Т - абсолютная температура, К,
F - число Фарадея, F = 96500 Кл,
n - число электронов, участвующих в реакции. Переходя от натурального логарифма к десятичному и подставляя в уравнение значение T=298K и соответствующие значения R и F, получаем выражение:
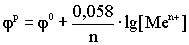
14.4. Устройство и работа гальванического элемента
Гальванический элемент - это устройство, состоящее из двух или более электродов, соединенных между собой.
ХИЭЭ – химический источник электроэнергии (гальванический элемент).В гальваническом элементе все время происходит нарушение равновесия данной реакции. 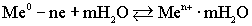 Гальванический элемент Якоби - Даниэля состоит из двух металлов с различными электродными потенциалами, например, меди и цинка. Электроды соединены между собой двояко. Металлические электроды соединены между собой металлическим проводником, а солевые растворы соединены либо полупроницаемой мембраной, либо электролитическим ключом. Электролитический ключ проводит анионы. Таким образом, в гальваническом элементе двоякая проводимость: электронная и ионная. Анодом является активный металл, катодом – пассивный.Чем меньше алгебраическая величина электродного потенциала, тем более активным является металл. В данном гальваническом элементе по соотношению потенциалов цинковый электрод является анодом, а медный - катодом. Анод окисляется:
Гальванический элемент Якоби - Даниэля состоит из двух металлов с различными электродными потенциалами, например, меди и цинка. Электроды соединены между собой двояко. Металлические электроды соединены между собой металлическим проводником, а солевые растворы соединены либо полупроницаемой мембраной, либо электролитическим ключом. Электролитический ключ проводит анионы. Таким образом, в гальваническом элементе двоякая проводимость: электронная и ионная. Анодом является активный металл, катодом – пассивный.Чем меньше алгебраическая величина электродного потенциала, тем более активным является металл. В данном гальваническом элементе по соотношению потенциалов цинковый электрод является анодом, а медный - катодом. Анод окисляется: 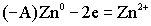 Освободившиеся электроны с анода переходят на катод, а ионы уходят в раствор. Ионы меди из солевого раствора подходят к металлу и здесь восстанавливаются:
Освободившиеся электроны с анода переходят на катод, а ионы уходят в раствор. Ионы меди из солевого раствора подходят к металлу и здесь восстанавливаются: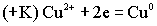 Избыток анионов из катодного солевого раствора в силу диффузии по электролитическому ключу переходит в катодный раствор, замыкая цепь.Во внутренней цепи гальванического элемента возникает электроток. Окислительно - восстановительная реакция
Избыток анионов из катодного солевого раствора в силу диффузии по электролитическому ключу переходит в катодный раствор, замыкая цепь.Во внутренней цепи гальванического элемента возникает электроток. Окислительно - восстановительная реакция 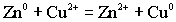
является причиной возникновения электротока. Кроме того, гальванический элемента обладает ЭДС, которая представляет собой разность между катодным и анодным потенциалами: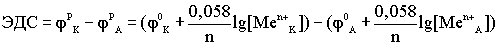
Электрохимическая схема гальванического элемента
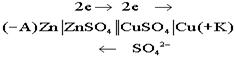
Недостатки элемента Якоби- Даниэля: малая Э Д С, разрушаемый анод.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 850; Нарушение авторских прав?; Мы поможем в написании вашей работы!