
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 16. Коррозия металлов
|
|
|
|
Понятие электролиза. Виды электролиза. Последовательность электродных процессов. Выход по току. Электролиз с нерастворимыми и растворимыми анодами. Законы Фарадея. Поляризация при электролизе. Перенапряжение электрода.
Лекция 15. Электролиз.
Упражнения для самоконтроля направлены на закрепление знаний в области расстановки коэффициентов в уравнениях ОВР, электродных потенциалов, гальванических элементов.
1. Коэффициент перед молекулой восстановителя в уравнении реакции
КМnО4+NаNО2+Н2SО4=МnSО4+К2SО4+NаNО3+Н2О равен: а) 1, б) 3; в)5, г)7.
2. Используя ряд активности металлов, определите в какой паре металлов можно получить наибольшее значение ЭДС в гальваническом элементе?
а) Mn - Sn, б) Mn - Ag; в) Mn - Fe, г) Mn - Au.
3. При окислении происходит:
ٱ взаимодействие с кислородом
ٱ перемещение электронной пары
ٱ отдача электронов атомом, молекулой или ионом
ٱ присоединение электронов
15.1. Понятие электролиза. Виды электролиза. Электролизом называется процесс раздельного окисления и восстановления на электродах, опущенных в раствор или расплав электролита, осуществляемый за счет протекания тока от внешнего источника ЭДС. Электролиз – это процесс, обратный процессу, происходящему при работе гальванических элементов. Электролизом называется превращение электрической энергии в химическую. Существует три вида электролиза:
1. Электролиз расплава
Электроды в данном случае выполнены из пассивных материалов (платина, графит)
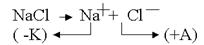 .На катоде всегда происходит восстановление, на аноде – окисление:
.На катоде всегда происходит восстановление, на аноде – окисление: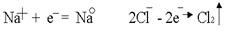 .
.
 2. Электролиз водного раствора электролита с пассивными электродами
2. Электролиз водного раствора электролита с пассивными электродами
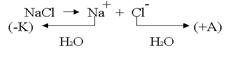 .К катоду подходят ионы натрия и молекулы воды.Чтобы выбрать, какое вещество будет восстанавливаться на катоде в первую очередь, надо сравнить потенциалы данных веществ
.К катоду подходят ионы натрия и молекулы воды.Чтобы выбрать, какое вещество будет восстанавливаться на катоде в первую очередь, надо сравнить потенциалы данных веществ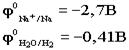 .По соотношению потенциалов этих двух веществ вода является более сильным окислителем и восстанавливается в первую очередь.
.По соотношению потенциалов этих двух веществ вода является более сильным окислителем и восстанавливается в первую очередь.
Катодное восстановление воды: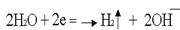 .
.
Чтобы выбрать, какое из веществ будет преимущественно окисляться на аноде, надо также сравнить их потенциалы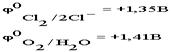 . По соотношению потенциалов видно, что ионы хлора являются более сильными восстановителями и, следовательно, будут окисляться в первую очередь.
. По соотношению потенциалов видно, что ионы хлора являются более сильными восстановителями и, следовательно, будут окисляться в первую очередь.
Анодное окисление хлора: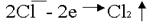 .
.
3. Электролиз раствора с активным анодом. Cu – активный анод, в качестве электролита – водный раствор H2SO4
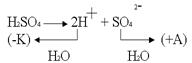 .По соотношению потенциалов в первую очередь будут восстанавливаться ионы водорода из кислоты
.По соотношению потенциалов в первую очередь будут восстанавливаться ионы водорода из кислоты
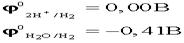 . .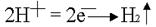 .На аноде могут окисляться три вещества: анионы электролита, молекулы воды и сам активный анод. .На аноде могут окисляться три вещества: анионы электролита, молекулы воды и сам активный анод.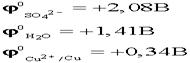 .По соотношению потенциалов активный анод будет окисляться в первую очередь: .По соотношению потенциалов активный анод будет окисляться в первую очередь: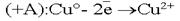 . В силу диффузии ионы меди из анодного пространства, где их концентрация высока, будут перемещаться к катоду. Когда . В силу диффузии ионы меди из анодного пространства, где их концентрация высока, будут перемещаться к катоду. Когда 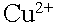 достигнет катода, то по соотношению потенциалов меди и водорода, начнется восстановление ионов меди: достигнет катода, то по соотношению потенциалов меди и водорода, начнется восстановление ионов меди: 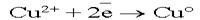 . .
| |
15.2.Законы Фарадея. Законы Фарадея являются количественными законами электролиза. Первый закон Фарадея: Масса вещества, выделяющегося на электродах, прямо пропорциональна количеству прошедшего через раствор электричества
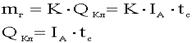 . Второй закон Фарадея: При прохождении через расплав или раствор электролита 96500 Кл электричества на электродах выделяется 1 моль эквивалента вещества. . Второй закон Фарадея: При прохождении через расплав или раствор электролита 96500 Кл электричества на электродах выделяется 1 моль эквивалента вещества.
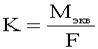 - электрохимический эквивалент вещества. - электрохимический эквивалент вещества. 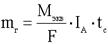 - объединённый закон Фарадея. - объединённый закон Фарадея.
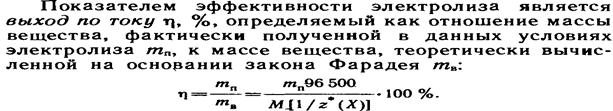 15.3.Поляризация при электролизе Поляризация при электролизе складывается из собственно поляризации, которая делится на химическую и концентрационную, и перенапряжения. Химическая поляризация возникает при использовании инертных электродов.
15.3.Поляризация при электролизе Поляризация при электролизе складывается из собственно поляризации, которая делится на химическую и концентрационную, и перенапряжения. Химическая поляризация возникает при использовании инертных электродов.
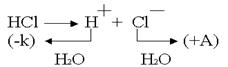 . . 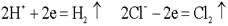 .Какими бы ни были инертные электроды (Pt, С, керамика), все они прекрасно адсорбируют газы. .Какими бы ни были инертные электроды (Pt, С, керамика), все они прекрасно адсорбируют газы.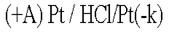 .Платина – анод насыщается хлором; платина – катод поглощает водород. Хлор может только восстанавливаться, водород - окисляться: .Платина – анод насыщается хлором; платина – катод поглощает водород. Хлор может только восстанавливаться, водород - окисляться: 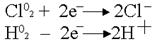 .В электролизере образуется гальванический элемент: .В электролизере образуется гальванический элемент:
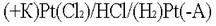 .Электродвижущая сила возникшего гальванического элемента направлена против внешнего напряжения и ослабляет его. Данный вид поляризации называется химическим по той причине, что электроды как бы меняют свою химическую природу. Поляризация играет отрицательную роль, так как она приводит к перерасходу электроэнергии. С химической поляризацией борются химическим путем. В раствор добавляют вещества, которые очищают электроды от поглощённых газов. Концентрационная поляризация происходит при активном аноде, например, серебряном .Электродвижущая сила возникшего гальванического элемента направлена против внешнего напряжения и ослабляет его. Данный вид поляризации называется химическим по той причине, что электроды как бы меняют свою химическую природу. Поляризация играет отрицательную роль, так как она приводит к перерасходу электроэнергии. С химической поляризацией борются химическим путем. В раствор добавляют вещества, которые очищают электроды от поглощённых газов. Концентрационная поляризация происходит при активном аноде, например, серебряном
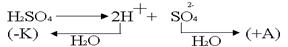  .
В силу диффузии ионы серебра от анода стремятся к катоду, где они начнут восстанавливаться как более сильные окислители. Поскольку диффузия в жидкостях медленная, концентрация ионов Ag в анодном пространстве намного выше, чем в катодном. Вследствие этого в электролизере возникает концентрационный гальванический элемент. ЭДС возникшего концентрационного элемента также направлена против внешнего напряжения и ослабляет его. С концентрационной поляризацией бороться гораздо проще, чем с химической. Ее устраняют перемешиванием раствора.
15.4.Перенапряжение электрода Перенапряжением электрода называют разность между фактическим и теоретическим электродными потенциалами. Перенапряжение металлов настолько мало, что им пренебрегают. Велико перенапряжение водорода и кислорода. Перенапряжение водорода велико при следующих условиях: малых плотностях тока, низких температурах раствора. Перенапряжение также зависит от материала катода. Перенапряжение водорода наиболее велико на тех металлах, которые в ряду напряжений располагаются вблизи водорода. Перенапряжение водорода может играть как отрицательную, так и положительную роль. Отрицательную роль оно играет при необходимости получить водород электролитическим путем. Положительна роль перенапряжения при необходимости получить с помощью электролиза какой - либо металл, находящийся в ряду напряжений до водорода. Можно создать условия (плотность тока, температура раствора, материал катода, посторонние ионы в растворе), при которых вследствие высокого перенапряжения водорода из раствора можно восстановить металлы, стоящие в ряду напряжения до водорода, (вплоть до алюминия). .
В силу диффузии ионы серебра от анода стремятся к катоду, где они начнут восстанавливаться как более сильные окислители. Поскольку диффузия в жидкостях медленная, концентрация ионов Ag в анодном пространстве намного выше, чем в катодном. Вследствие этого в электролизере возникает концентрационный гальванический элемент. ЭДС возникшего концентрационного элемента также направлена против внешнего напряжения и ослабляет его. С концентрационной поляризацией бороться гораздо проще, чем с химической. Ее устраняют перемешиванием раствора.
15.4.Перенапряжение электрода Перенапряжением электрода называют разность между фактическим и теоретическим электродными потенциалами. Перенапряжение металлов настолько мало, что им пренебрегают. Велико перенапряжение водорода и кислорода. Перенапряжение водорода велико при следующих условиях: малых плотностях тока, низких температурах раствора. Перенапряжение также зависит от материала катода. Перенапряжение водорода наиболее велико на тех металлах, которые в ряду напряжений располагаются вблизи водорода. Перенапряжение водорода может играть как отрицательную, так и положительную роль. Отрицательную роль оно играет при необходимости получить водород электролитическим путем. Положительна роль перенапряжения при необходимости получить с помощью электролиза какой - либо металл, находящийся в ряду напряжений до водорода. Можно создать условия (плотность тока, температура раствора, материал катода, посторонние ионы в растворе), при которых вследствие высокого перенапряжения водорода из раствора можно восстановить металлы, стоящие в ряду напряжения до водорода, (вплоть до алюминия).
|
Вопросы для самопроверки:
1. Что будет выделяться на катоде и аноде, если водный раствор сульфата меди (II) подвергнуть электролизу?
ٱ Cu и SO4 ٱ Cu и O2 ٱ H2 и O2 ٱ H2 и SO4
Основные виды коррозии. Классификация коррозионный процессов. Химическая и электрохимическая коррозии. Газовая, атмосферная, почвенная коррозия, коррозия под действием блуждающих токов. Коррозия в электролитах, в не электролитах, биохимическая коррозия. Окислительно-восстановительные процессы, протекающие при различных видах коррозии. Методы защиты от коррозии. Анодные и катодные покрытия. Протекторная и электрозащита. Ингибиторы коррозии.
1. Основные виды коррозии. Коррозия металлов – разрушение металлов под действием агрессивной окружающей среды. Виды коррозии: плошная; участками; питтинг; межзерновая; растрескивание; селективная. Все виды коррозии одинаково опасны. По механизмам протекания процесса коррозия подразделяется на химическую и электрохимическую. Химическая коррозия: газовая; жидкостная. Газовая коррозия происходит под влиянием агрессивных сухих газов.
Жидкостная коррозия вызывается растворами неэлектролитов. Этот вид коррозии очень характерен для продуктов нефтехимии.
Электрохимическая коррозия отличается от химической коррозии тем, что в системе возникает направленный поток электронов, т.е. электрохимическая коррозия возникает там, где присутствуют электролиты. Электрохимическая коррозия: гальванокоррозия (аналогична работе гальванического элемента); электрокоррозия (представляет собой электролиз). Электрохимическая коррозия гораздо активнее химической коррозии. Гальванокоррозия вызывается многими причинами.
Основная причина возникновения гальванокоррозии - тесный контакт двух металлов с различными потенциалами, находящихся в среде электролита.
Металлы, находящиеся в тесном контакте (спай), образуют короткозамкнутый гальванический элемент.
Например, спай алюминия с медью.По соотношению потенциалов алюминий является анодом, медь – катодом. Рассмотрим данную гальванопару в кислой среде: Разрушается анод, в данном случае алюминий.Второй причиной возникновения гальванокоррозии является неоднородность металлов. Больше всего это относится к техническому железу – чугунам и сталям.
Разрушается анод, в данном случае алюминий.Второй причиной возникновения гальванокоррозии является неоднородность металлов. Больше всего это относится к техническому железу – чугунам и сталям.
Техническое железо состоит в основном из кристаллов железа и участков цементита.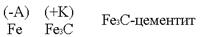 Кристаллы железа играют роль микроанодов, участки цементита – микрокатодов.
Кристаллы железа играют роль микроанодов, участки цементита – микрокатодов.
Рассмотрим данную систему в окружающей среде: воздухе с содержащейся в нём влагой (О2+2Н2О).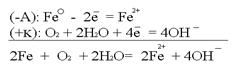 Следующей распространённой причиной возникновения гальванокоррозии является аэрация – неравномерный доступ кислорода (или воздуха) к разным участкам одного и того же металла.Примером может служить вбитый во влажное дерево гвоздь. Та часть изделия (гвоздя), к которой доступ воздуха свободен, является катодом. Часть гвоздя, находящаяся в дереве, является анодом. Возникает коррозия:
Следующей распространённой причиной возникновения гальванокоррозии является аэрация – неравномерный доступ кислорода (или воздуха) к разным участкам одного и того же металла.Примером может служить вбитый во влажное дерево гвоздь. Та часть изделия (гвоздя), к которой доступ воздуха свободен, является катодом. Часть гвоздя, находящаяся в дереве, является анодом. Возникает коррозия: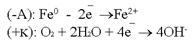 Электрокоррозия – это коррозия материалов под влиянием электрического тока от внешнего источника (коррозия блуждающих токов).
Электрокоррозия – это коррозия материалов под влиянием электрического тока от внешнего источника (коррозия блуждающих токов).
Источниками блуждающих токов являются: весь электротранспорт, электроаппараты, работающие на земле. Поток электронов, идущий по рельсу, встречая какое -– либо омическое сопротивление, например стык, уходит в почву. Этот участок рельса становился катодом по отношению к близко расположенному участку трубопровода. Почва по своему составу является прекрасным проводником электронов. В почве такой поток электронов может пройти десятки километров. На своём пути поток электронов встречает какой-либо металлический предмет, например, трубопровод, и входит в него. Данный участок трубопровода становится анодом и начинает разрушаться: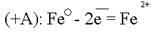 Ионы Fe уходят в землю, а поток электронов направляется далее по трубопроводу до тех пор, пока не встретит какое-либо новое сопротивление. Встретив сопротивление, электроны уходят в землю, превращая данный участок трубопровода в катод. Поток электронов может войти в тот же рельс, откуда он вышел, превращая его в анод. Катодный процесс зависит от состава почвы.
Ионы Fe уходят в землю, а поток электронов направляется далее по трубопроводу до тех пор, пока не встретит какое-либо новое сопротивление. Встретив сопротивление, электроны уходят в землю, превращая данный участок трубопровода в катод. Поток электронов может войти в тот же рельс, откуда он вышел, превращая его в анод. Катодный процесс зависит от состава почвы.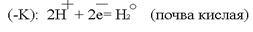 или
или 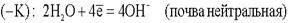 .
.
2.Защита металлов от коррозии В результате коррозии металлические изделия разрушаются, причем в таком количестве, что борьба с коррозией необходима.
Способов борьбы с коррозией очень много. Основные способы: электрозащита; защитные покрытия, которые подразделяются на металлические и неметаллические; легирование.
Электрозащита К электрозащите относятся способы, при которых в системе возникает направленный поток электронов: катодная защита, протекторная защита.
Катодная защита. Суть её сводится к следующему: к катоду внешнего источника питания присоединяют защищаемый металл, к аноду – ненужный кусок металла. Пока поступает ток от внешнего источника, анод разрушается, а катод остается в целости и сохранности. Недостатком этого метода является расход электроэнергии.
Протекторная защита. Суть ее: два металла - защищаемый и протектор - приводятся в тесный контакт. Металл протектора подбирается так, чтобы он оказался анодом по отношению к защищаемому изделию. В первую очередь разрушается анод, защищаемое изделие сохраняется.
Данный вид защиты относится к электрозащите, так как в системе возникает направленный поток электронов.
Электрозащита применяется в тех случаях, когда объём окружающей агрессивной среды очень велик. Электрозащита применяется на морских судах (подводные части), для защиты всех подводных и подземных сооружений. Защитные металлические покрытия В качестве первых защитных металлических покрытий использовались цинк и олово.Покрытие цинком – цинкование. Покрытие оловом – лужение. По соотношению потенциалов защищаемого металла и покрытия все защитные покрытия делятся на:катодные покрытия; анодные покрытия. 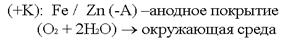 В случае нарушения защитного покрытия в первую очередь начнёт разрушаться само покрытие:
В случае нарушения защитного покрытия в первую очередь начнёт разрушаться само покрытие: 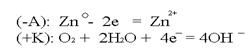 Анодные покрытия выгоднее тем, что начинает разрушаться само покрытие, т.е. есть возможность восстановить его, прежде чем начнет разрушаться основное изделие.
Анодные покрытия выгоднее тем, что начинает разрушаться само покрытие, т.е. есть возможность восстановить его, прежде чем начнет разрушаться основное изделие.
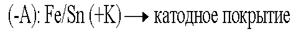
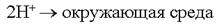 При разрушении покрытия будет разрушаться защищаемый металл.
При разрушении покрытия будет разрушаться защищаемый металл.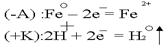
В настоящее время металлические покрытия широко применяются, и назначения этих покрытий весьма различны. Кроме защитной функции, они могут выполнять декоративную функцию, а также весьма различные технологические назначения. Поэтому покрытия наносятся без учета того, анодными или катодными они являются. Защитные неметаллические покрытия. Сюда относятся краски, лаки, эмали, полимеры. Также сюда относятся фосфотирование и оксидирование (воронение) стали. Оксидирование стали. На стали получают оксидную пленку сложного состава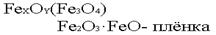
Эта пленка интенсивно черного цвета, отсюда и название – воронение. Структура пленки - плотная, беспористая, сцепление её с металлом очень прочное. При толщине пленки в 30-40 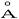 она надежно защищает изделия от коррозии.
она надежно защищает изделия от коррозии.
Фосфотирование производят из смеси, например, ZnHPO4 + фосфорная кислота
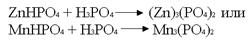 .Эти фосфатные пленки имеют хорошее прочное сцепление с техническим железом (сталь, чугун). Но поскольку пленки пористые, сами по себе они изделия от коррозии не защищают. В этом случае применяется дополнительная защита – краска. В соединении с краской защита очень надежна.
.Эти фосфатные пленки имеют хорошее прочное сцепление с техническим железом (сталь, чугун). Но поскольку пленки пористые, сами по себе они изделия от коррозии не защищают. В этом случае применяется дополнительная защита – краска. В соединении с краской защита очень надежна.
На практике, как правило, применяется не один вид защиты, а как минимум два.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1618; Нарушение авторских прав?; Мы поможем в написании вашей работы!