
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродный потенциал
|
|
|
|
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Процессы взаимного превращения химической и электрической форм энергии называются электрохимическими. Их принято делить на две основные группы: 1) процессы превращения химической энергии в электрическую (реализуются в химических источниках тока); 2) процессы превращения электрической энергии в химическую (наблюдаются при электролизе).
Простейшая электрохимическая система состоит из двух электродов (иначе полуэлементов) и ионного проводника. Полуэлемент чаще всего представляет собой металл, помещенный в раствор, содержащий ионы, способные восстанавливаться или окисляться, а ионным проводником, как правило, служит раствор или расплав электролита.
Каждый электрод, характеризуется определенным значением условного электродного потенциала Е, который в стандартных условиях определяется экспериментально относительно потенциала стандартного водородного электрода (СВЭ). СВЭ – это газовый электрод, который состоит из платины, контактирующей с газообразным водородом (Р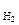 = 1 атм.) и раствором, в котором активность ионов водорода а
= 1 атм.) и раствором, в котором активность ионов водорода а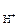 = 1 моль/дм3. Равновесие в водородном электроде отражается уравнением
= 1 моль/дм3. Равновесие в водородном электроде отражается уравнением
Н+ + 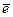 «½ Н2
«½ Н2
Абсолютное значение потенциала СВЭ неизвестно, но условно его считают равным нулю (Е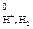 = 0 В).
= 0 В).
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 507; Нарушение авторских прав?; Мы поможем в написании вашей работы!