
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Виды электродов
|
|
|
|
По свойствам веществ, участвующих в потенциалопределяющих процессах, принята следующая классификация электродов: электроды первого и второго рода, газовые, окислительно-восстановительные, ионообменные.
К электродам первого рода в первую очередь относятся металлические электроды, обратимые относительно катиона. Это полуэлемент, в котором металл Ме погружен в раствор, содержащий ионы данного металла Ме n +:
Ме n + ½ Ме.
Потенциалопределяющая реакция электрода выражается схемой
Ме n+ раствор + n∙ 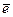 «Метв.
«Метв.
Потенциалы полуэлементов рассчитывают по уравнению Нернста, которое при температуре 298 К для данного типа электродов имеет вид:
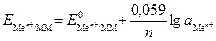 (4)
(4)
где Е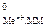 - стандартный электродный потенциал металла, В; а
- стандартный электродный потенциал металла, В; а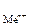 - активность ионов металла в растворе, моль/дм3.
- активность ионов металла в растворе, моль/дм3.
Значения стандартных электродных потенциалов практически для всех полуэлементов определены экспериментально и содержатся в справочной литературе. При расчетах потенциалов металлических электродов активность ионов металла можно считать приблизительно равной их молярной концентрации а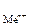 » [Ме n +].
» [Ме n +].
К электродам первого рода относятся также газовые, которые создаются по схеме:
раствор ½газ, металл.
Металл в газовых электродах необходим для создания электропроводящего контакта между газом и раствором, при этом сам металл должен оставаться инертным по отношению к веществам находящимся в растворе. Наиболее подходящим металлом, отвечающим всем условиям, является платина.
Самым распространенным газовым электродом является водородный электрод. Уравнение Нернста в этом случае имеет вид
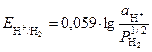 , (5)
, (5)
где а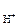 – активность ионов водорода в растворе, моль/дм3; Р
– активность ионов водорода в растворе, моль/дм3; Р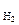 – парциальное давление водорода над раствором, атм.
– парциальное давление водорода над раствором, атм.
Если давление водорода считать равным 1 атм., то уравнение Нернста примет вид
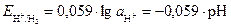 , (6)
, (6)
где рН – водородный показатель среды.
Кислородный электрод по устройству аналогичен водородному. В щелочной среде электродное равновесие имеет вид
О2 + 2Н2О + 4×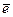 «4ОН–.
«4ОН–.
Уравнение для расчета потенциала
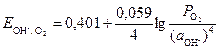 , (7)
, (7)
где а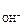 – активность гидроксид-ионов в растворе, моль/дм3; Р
– активность гидроксид-ионов в растворе, моль/дм3; Р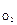 – парциальное давление кислорода над раствором, атм.
– парциальное давление кислорода над раствором, атм.
В кислой среде электродное равновесие кислородного полуэлемента и уравнение для расчета потенциала передаются выражениями
О2 + 4Н+ + 4×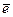 «2Н2О
«2Н2О
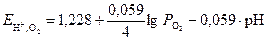 . (8)
. (8)
На практике потенциал кислородного электрода не соответствует уравнению (8), так как механизм реакций, протекающих на данном электроде сложнее из-за протекания побочных процессов.
Электродом второго рода называют систему, в которой металл покрыт слоем его труднорастворимого соединения (соли, оксида или гидроксида), а в растворе находятся анионы, одноименные с анионами, содержащимися в этом труднорастворимом соединении: А n– ½ MeA, Ме. Электродное равновесие имеет вид
MeAтв + n ×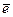 «Метв + А n– раствор.
«Метв + А n– раствор.
Уравнение Нернста для этого случая передается формулой
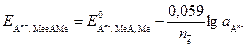 , (9)
, (9)
где 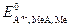 - стандартный потенциал электрода второго рода, В;
- стандартный потенциал электрода второго рода, В; 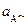 - активность анионов в растворе, моль/дм3.
- активность анионов в растворе, моль/дм3.
К окислительно-восстановительным (иначе редокси-электродам) относят электроды, в потенциалопределяющих реакциях которых не участвую простые вещества – металлы, газы. Они состоят из инертного вещества, обладающего электронной проводимостью (чаще всего платины), погруженного в раствор, содержащий частицы (ионы или молекулы) способные окисляться и восстанавливаться. В общем виде схема электрода и уравнение реакции записывают так
Оx, Red ½ Pt; Оx + n ×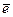 «Red.
«Red.
Редокси-электроды бывают простые и сложные. К простым редокси-электродам относят полуэлементы, у которых окисленная и восстановленная формы представляют собой ионы, причем электродная реакция состоит в перемене их заряда. Например, системе Sn4+, Sn2+ ½ Pt соответствует реакция
Sn4+ + 2×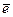 «Sn2+ .
«Sn2+ .
Потенциал простого окислительно-восстановительного полуэлемента рассчитывают по формуле
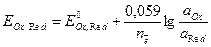 , (10)
, (10)
где 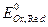 – стандартный потенциал редокси-электрода,В; аOx, aRed – активности окисленной и восстановленной форм, моль/дм3.
– стандартный потенциал редокси-электрода,В; аOx, aRed – активности окисленной и восстановленной форм, моль/дм3.
В основе работы сложного редокси-электрода лежит потенциалопределяющая реакция, в которой участвуют ионы Н+ и молекулы воды. Например, системе 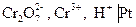 отвечает электродная реакция
отвечает электродная реакция
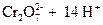 + 6×
+ 6×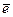 «
«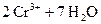 .
.
Расчет потенциала данного электрода производится по уравнению
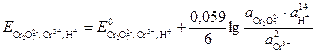 .
.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 2018; Нарушение авторских прав?; Мы поможем в написании вашей работы!