
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диаграммы Пурбе
|
|
|
|
Бельгийский ученый Пурбе предложил метод изучения равновесий в системах элемент-вода. Суть метода состоит в исследовании всех возможных равновесий в системе и в представлении результатов в виде табличных данных и в виде графических зависимостей в координатах потенциал-рН. Последние получили название диаграмм Пурбе.
Диаграммы используют для определения границ термодинамической устойчивости соединений и заключений о возможности протекания реакций. В последнее время получили распространение комплексные исследования, в том числе и с использованием диаграмм Пурбе, для разработки отдельных моделей коррозионных процессов. При построении диаграмм учитывают три типа равновесий в системе металл-вода.

1. Равновесный обмен электрическими зарядами:
Эти равновесия не зависят от рН, а зависят только от потенциала. Линии, которые характеризуют этот процесс, параллельны оси рН.
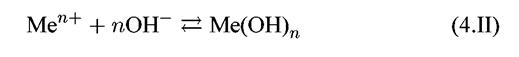
2. Ионно-молекулярные равновесия, не связанные с величиной потенциала. Они зависят только от величины рН:
На диаграмме Пурбе им отвечают линии, параллельные оси потенциалов.
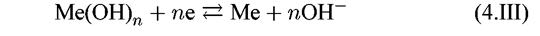
3. Равновесия, которые зависят как от потенциала, так и от рН:
Потенциал такого электрода определяется уравнением:
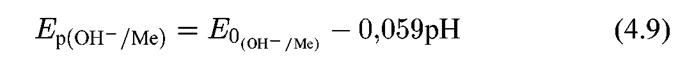
Линия равновесия имеет наклон относительно двух осей.
Примеры. Рассмотрим фрагмент диаграммы E -рН для воды (рис. 4.2). Основные реакции и соответствующие им уравнения приведены в таблице 4.2.
Линии 2 и 3 соответствуют электрохимическим равновесиям воды с продуктами ее восстановления — водородом (линия 2) и окисления — кислородом (линия 3). При потенциалах, лежащих выше линии 3, вода окисляется, а при потенциалах ниже линии 2 — восстанавливается.
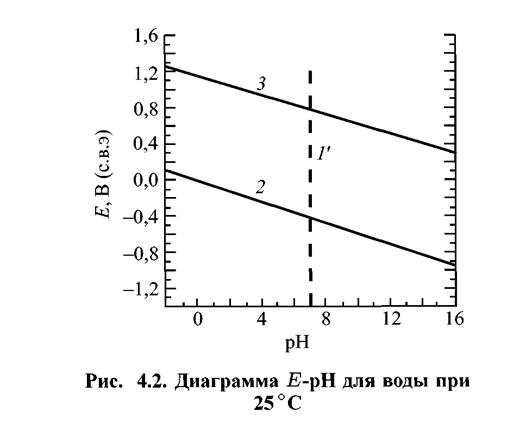
Кривые 2 и 3 приведены для случая, когда активности ионов равны 1.
Кривая 1' соответствует равенству активности ионов Н+ и ОН-, находящихся в равновесии друг с другом. Часто линию 2 обозначают буквой «b», а линию 3 буквой «а». Их наносят в виде пунктира на диаграммы Пурбе системы элемент-вода для выделения области устойчивости воды.

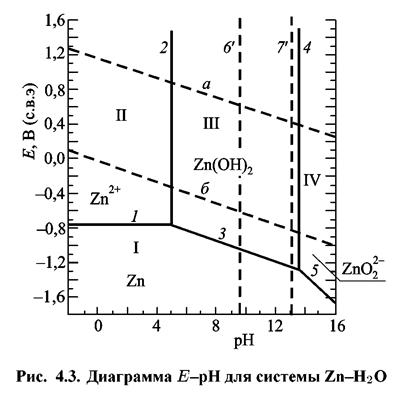 Боле сложный случай равновесий наблюдают в системе Zn-Н2О, в которой возможно образование нескольких различных ионов (табл. 4.3).
Боле сложный случай равновесий наблюдают в системе Zn-Н2О, в которой возможно образование нескольких различных ионов (табл. 4.3).
Диаграмма имеет четыре области (рис. 4.3):
I — область термодинамической устойчивости Zn (область катодной защиты);
II и IV — области растворения Zn (области коррозии);
III — область пассивности.
Линия I отвечает условию равновесия процесса ионизации цинка. Ниже этой линии находится область термодинамической устойчивости металла, выше происходит растворение Zn.
При значениях рН, соответствующих левой части диаграммы (область II) образуются катионы Zn2+, в области IV — анионы ZnO2-
Между ними находится зона III (облать пассивации), где происходит образование нерастворимого гидроксида Zn(OH)2.
Линии 61 и 7' определяют значения рН, отвечающие равновесию между Zn2+, HZnO- и ZnO-2, для частного случая равенства активностей ионов: Ζn2+/ΗZnΟ-при ρΗ рН = 9,21 (кривая 6'); ΗZnΟ-/ΖnΟ2-2 при рН = 13,11 (кривая 7'). Слева от линии 6' находится область преобладания ионов Ζn2+, справа — область преобладания ΖnΟ2-2 Аналогично, слева от линии 7' — область преобладания ΗZnΟ-, справа — ΖnΟ-2,
|
|
|
Дата добавления: 2014-01-03; Просмотров: 7344; Нарушение авторских прав?; Мы поможем в написании вашей работы!