
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамика электрохимической коррозии
|
|
|
|
Причиной электрохимической коррозии является термодинамическая неустойчивость металлов в среде электролита.
Химический потенциал (mi), термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. В случае системы, состоящей из i компонентов, химический потенциал определяется как приращение внутренней энергии U системы при добавлении к системе бесконечно малого количества молей i-того компонента, отнесённое к этому количеству вещества, при постоянных объёме V, энтропии S и количествах молей каждого из остальных компонентов nj (j ¹ i). В общем случае химический потенциал может быть определён как приращение любого из остальных потенциалов термодинамических системы при различных постоянных параметрах: гиббсовой энергии G — при постоянных давлении р, температуре Т и nj; гельмгольцевой энергии А — при постоянных V, Т и nj; энтальпии Н — при постоянных S, р и nj. Таким образом:
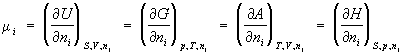 (1)
(1)
Химический потенциал зависит от концентрации данного компонента, и от температуры:
mi = mi 0+ RT ln ai,
Электрохимический потенциал
mEi = mi 0+ RT ln ai + n F φ,
φ – внутренний потенциал – работа переноса единичного положительного точечного заряда из бесконечности в вакууме в фазу.
Условие равновесия при переходе заряженной частицы через межфазную границу равенство ее электрохимических потенциалов в обеих фазах.
(mEi)металл = (mEi)раствор
E=[(φ)металл-(φ)раствор ]- const - Электродный потенциал
const - электродный потенциал электрода сравнения.
Отсюда следует уравнение Нернста
Величина равновесного потенциала зависит от температуры и активности реагирующих веществ и может быть рассчитана по уравнению Нернста:
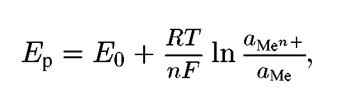 (4.2)
(4.2)
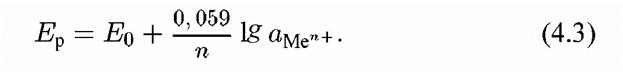
где E0 - стандартный потенциал металла; R - газовая постоянная; Τ - абсолютная температура; aMen+ - активность ионов металла в г-ион/л; а ме - активность металла, которую принимают равной 1; n - число электронов, участвующих в реакции. Если представить все константы при температуре 298o К и выразить зависимость в десятичных логарифмах то
Если активность ионов металла в растворе равна единице, то второй член уравнения Нернста превращается в нуль. Электродный потенциал при этом становится равным стандартному потенциалу. Таким образом, стандартный электродный потенциал представляет собой частный случай равновесного потенциала. Значение стандартных потенциалов для некоторых металлов приведены в табл. 4.1.
Т 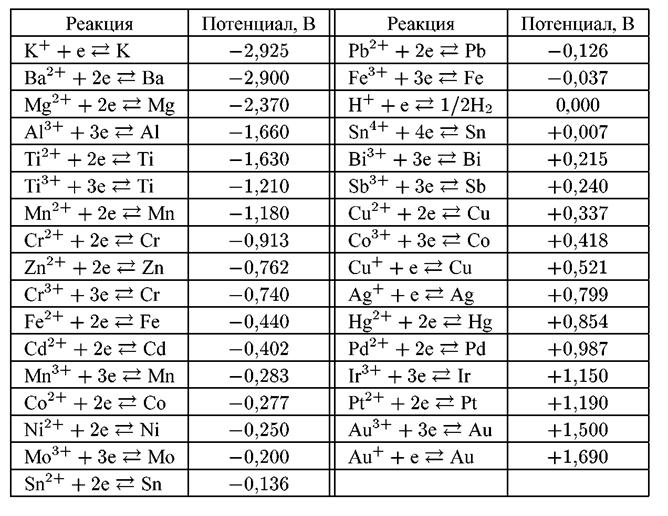
Таблица 4.1 Стандартные потенциалы металлов
В реальных условиях коррозии металла в реакциях обмена участвуют не только ионы металла, но и другие компоненты раствора.
В этих случаях устанавливаются стационарные или необратимые значения потенциалов. Необратимые потенциалы не могут быть отнесены к прямой и обратной реакциям одного и того же процесса и их нельзя вычислить по уравнению Нернста.
Измерить абсолютное значение потенциала в настоящее время технически невозможно, он может быть замерен только по отношению к какому-то электроду сравнения. В качестве основного электрода сравнения принят стандартный водородный электрод. Наиболее часто в качестве электрода сравнения применяют каломельный и хлоридсеребряный электроды.
Существуют и другие виды электродов сравнения, с которыми можно более подробно познакомиться в учебниках по физической химии и электрохимии.
Процесс электрохимической коррозии представляет собой совокупность двух сопряженно протекающих реакций.

Металл является донором электронов и на его поверхности протекает анодная реакция:
Me → Меn+ + ne
Катодная реакция, которую называют катодной деполяризующей реакцией, протекает с участием компонентов электропроводящей среды. В качестве последней чаще всего выступают водные растворы кислот, щелочей или солей.
Акцепторами электронов могут быть либо ионы H+ или молекулы H2O (водородная деполяризация):
H3O+ + е = 1/2Н2 + Н2О в кислых растворах,
2Н2О + 2е = Н2 + 2ОН- в щелочных растворах,
либо кислород O2 (кислородная деполяризация):
О2 + Н2О + 4е = 4ОН- в нейтральных и щелочных растворах,
О2+ 4Н+ + 4е = 2Н2О в кислых растворах.
рН влияет на величину равновесного потенциала.
Запишем уравнение Нернста для водородной деполяризации:
Eр(H+/H2) = E0(H+/H2) + 0,059 lg a H+, (4.4)
Если учесть, что стандартный потенциал водородного электрода принят равным нулю, а десятичный логарифм активности водородных ионов есть величина рН, взятая с обратным знаком, то получим:
Eр(H+/H2) = -0,059рН. (4.5)
Это означает, что при увеличении рН на единицу потенциал водородного электрода уменьшается на 59 мВ.
Потенциал кислородного электрода положительнее водородного электрода на 1,23 В, т.е.
Eр(O2/OH-) = 1.23 - 0,059 pH. (4.6)
В кислой среде при рН = 0 и при а н+ = 1 моль/л: Eр(Н+/Н2) = 0, а Eр(о2/он-) = +1,23В.
В нейтральной среде при рН = 7 и при а н+ = 10-7 моль/л: Eр(Н+/н2)=-0,415 В, а Eр(о2/он-) = +0,815 В.
Для электрохимических реакций свободная энергия Гиббса рассчитывается по уравнению

где F — число Фарадея, n — число электронов, участвующих в реакции, ΔЕ — разность равновесных потенциалов катодной и анодной реакции:
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 5163; Нарушение авторских прав?; Мы поможем в написании вашей работы!