
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адсорбция газов на поверхности металлов
|
|
|
|
Адсорбцией называют изменение концентрации вещества на границе раздела фаз. Адсорбционное равновесие, т.е. равновесное распределение вещества между пограничным слоем и граничащими фазами, является динамическим и быстро устанавливается.
Частицы, которые находятся на поверхности твердого тела, обладают избыточной энергией. За счет этого молекулы окружающей среды притягиваются к металлу и концентрируются на его поверхности. Этот процесс протекает всегда самопроизвольно и с положительным тепловым эффектом.
Различают два вида адсорбции: физическую и химическую.
Физическая адсорбция обусловлена вандерваальсовскими силами. Энергия связи между молекулами адсорбата и поверхностью металла невелика (порядка 40-50 кДж/моль). Равновесие устанавливается быстро. Адсорбированные вещества могут быть легко удалены с поверхности. Физическая адсорбция наиболее отчетливо проявляется при низких температурах, близких к температуре конденсации адсорбата.
Хемосорбцией называется процесс адсорбции, сопровождающийся химической реакцией между молекулами адсорбированного вещества и металлом. Энергия связи между атомами оценивается величинами 150-160 кДж/моль. Связь, возникающая между металлом и окислителем, имеет ионный характер. Металл отдает атому адсорбированного вещества электроны. Процесс хемосорбции протекает очень быстро (доли секунды). Внешняя поверхность адсорбированной пленки при этом заряжается отрицательно, а внутренняя — положительно.
Количество адсорбированного вещества, отнесенное к единице поверхности, зависит от температуры среды и концентрации адсорбата в газовой или жидкой фазе.
Функциональная зависимость между равновесным количеством адсорбата на поверхности твердого тела и концентрацией или давлением Ρ (если адсорбата является газом) при Τ = const называется изотермой адсорбции.
Впервые теоретическое обоснование изотермы адсорбции было дано Ленгмюром. Им было сделано несколько допущений, упрощающих модель процесса.
Предполагалось, что:
• поверхность адсорбента энергетически однородна;
• частицы адсорбата на поверхности никак не взаимодействуют друг с другом;
• на один активный центр поверхности приходится одна частица адсорбированного вещества;
• может образовываться только мономолекулярный адсорбционный слой.
Скорость процесса адсорбции vад будет прямо пропорциональна давлению газа Ρ и величине свободной поверхности металла (1-Θ):
где Кад — константа, характеризующая
скорость процесса адсорбции.
 |
Скорость обратного процесса — десорбции — будет прямо пропорциональна поверхности, занятой реагирующими молекулами:
где Кдес — константа, характеризующая процесс десорбции, а Θ —
доля поверхности металла, занятая частицами адсорбата.
 |
При установлении равновесия скорость адсорбции равна скорости десорбции:
 |
Приравнивая правые части уравнений (3.1) и (3.2), получаем:
Решая уравнение (3.4) относительноθ, получим:

Разделив числитель и знаменатель на Кдес и обозначив Кад/Кдес = P, получим:
где b — адсорбционный
коэффициент.
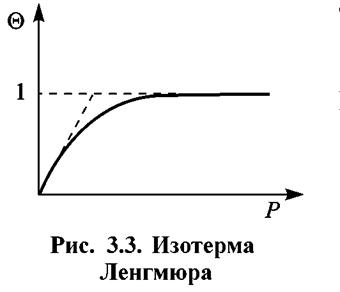
Уравнение (3.6) носит название изотермы. Ее графическое выражение дано на рис. 3.3.
При θ = 1 получается горизонтальный участок, отвечающий образованию заполненного монослоя.
При слабой адсорбции (θ мала) или при низком давлении газа (мало Р) можно принять, что 1 + ЬР = 1 и тогда из (3.6) получим:

При этих условиях степень заполнения поверхности мала и пропорциональна давлению.
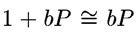 Выражение (3.7) отражает закон распределения и носит название изотермы Генри.
Выражение (3.7) отражает закон распределения и носит название изотермы Генри.
При высоком давлении справедливо допущение
И мы получаем из уравнения (3.6): Θ =1
Это означает, что все активные центры на поверхности металла полностью заполнены адсорбированным веществом и дальнейшее увеличение его парциального давления в газовой фазе не влияет на количество вещества, адсорбированного на поверхности твердого тела. Этому состоянию отвечает правый участок на кривой изотермы, т.е. прямая линия (рис. 3.3).
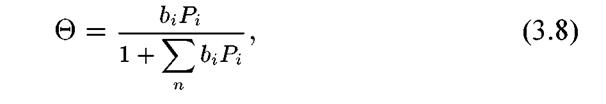 |
Если на поверхности металла адсорбируется смесь газов, то степень заполнения поверхности г-м газом рассчитывается по уравнению:
где сумма берется по всем «i» компонентам газовой смеси.
В большинстве случаев поверхность твердого металла энергетически неоднородна. Она представляет собой серию элементарных площадок, обладающих различной теплотой адсорбции.
Экспериментальные данные более точно описываются уравнением:
где f — коэффициент,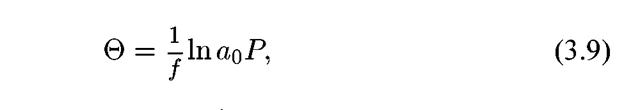
отражающий функцию распределения, а а0 — адсорбционный коэффициент при наибольшей теплоте адсорбции.
Выражение (3.9) получило название логарифмической изотермы адсорбции. Экспериментально она впервые была описана в работах А.Н. Фрумкина и А.И. Шлыгина. Теоретический вывод уравнения этой изотермы сделан М.И. Темкиным.
Адсорбция может быть мономолекулярной и полимолекулярной. В последнем случае на поверхности адсорбента образуется несколько слоев. Первый мономолекулярный слой обусловлен силами взаимодействия между поверхностью твердого тела и адсорбатом. Второй и последующие слои удерживаются вандерваальсовскими силами. Слои адсорбата распределяются по поверхности неравномерно. На некоторых участках их может быть два или три слоя. Одновременно могут остаться участки, закрытые монослоем или совсем свободные от адсорбата (рис. 3.5).
На рис. 3.4 представлена изотерма адсорбции кислорода. Участки ab и bc отвечают мономолекулярной адсорбции, участок cd — полимолекулярной. 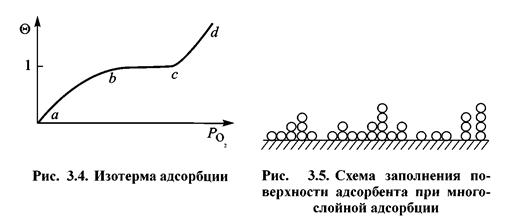
На рис. 3.5 представлена схема заполнения поверхности металла адсорбированным веществом по теории Брунауэра.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1672; Нарушение авторских прав?; Мы поможем в написании вашей работы!