
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Политропный процесс
|
|
|
|
Политропный процесс можно определить как термодинамический процесс изменения параметров идеального газа при постоянной теплоемкости 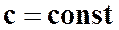 .
.
Все термодинамические процессы являются частными случаями политропного процесса.
Для политропного процесса первое начало термодинамики имеет вид
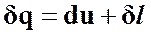 (45)
(45)
или
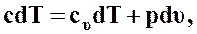 (46)
(46)
где 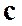 ¾ массовая теплоемкость газа в политропном процессе.
¾ массовая теплоемкость газа в политропном процессе.
Также первое начало термодинамики для политропного процесса можно представить в виде
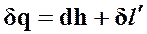 (47)
(47)
или
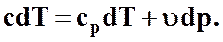 (48)
(48)
Из выражения первого начала термодинамики в форме (46) найдем уравнение политропного процесса

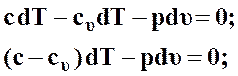 (49)
(49)
Воспользуемся выражением (35)
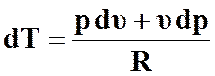 ,
,
тогда
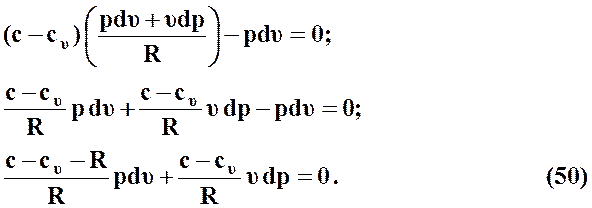
Согласно формуле Майера
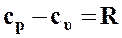 ,
,
тогда выражение (50) примет вид
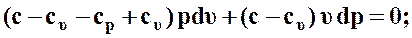
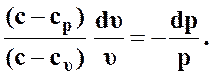 (51)
(51)
Обозначим отношение
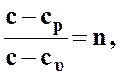
где 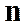 ¾ показатель политропы.
¾ показатель политропы.
Тогда
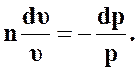 (52)
(52)
Проинтегрируем выражение (52)
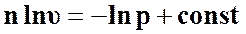 (53)
(53)
или
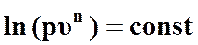 . (54)
. (54)
Таким образом, если логарифм некоторой функции величина постоянная, то и сама функция является постоянной величиной
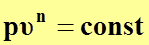 . (55)
. (55)
Выражение (55) представляет собой уравнение политропного процесса.
Выразим теплоемкость идеального газа в политропном процессе через известную изохорную теплоемкость.
Из выражения для показателя политропы
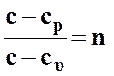 и показателя адиабаты
и показателя адиабаты 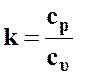 имеем
имеем
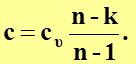 (56)
(56)
С учетом выражения (46) и уравнения состояния 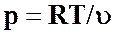 можно записать
можно записать
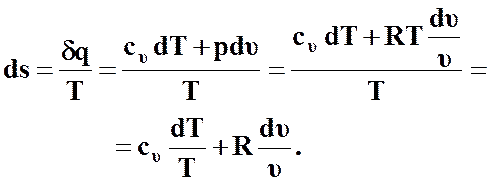 (57)
(57)
В интегральной форме первое начало термодинамики для политропного процесса будет иметь вид
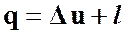 (58)
(58)
или
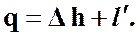 (59)
(59)
Из выражений (45) ─ (59) следует, что для политропного процесса идеального газа 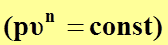 :
:
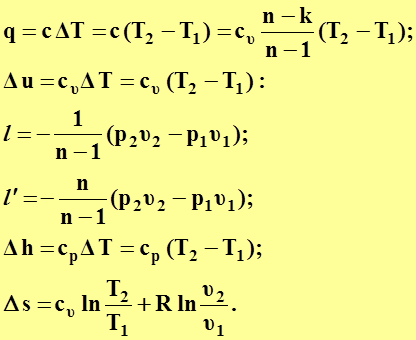 (60)
(60)
Показать политропы 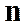 может меняться от 0 до µ.
может меняться от 0 до µ.
Рассмотрим частные случаи:
1. при 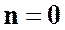 уравнение политропного процесса
уравнение политропного процесса 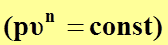 переходит в уравнение изобарного процесса
переходит в уравнение изобарного процесса 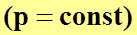 ;
;
2. при 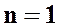 уравнение политропного процесса
уравнение политропного процесса 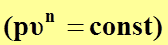 переходит в уравнение изотермического процесса
переходит в уравнение изотермического процесса 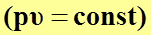 ;
;
3. при 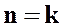 уравнение политропного процесса
уравнение политропного процесса 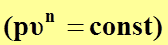 переходит в уравнение адиабатного процесса
переходит в уравнение адиабатного процесса 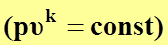 .
.
4. при 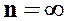 уравнение политропного процесса
уравнение политропного процесса 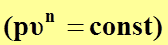 переходит в уравнение изохорного процесса
переходит в уравнение изохорного процесса 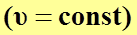 .
.
На рисунках 5 и 6 изображены все представленные термодинамические процессы в 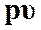 и
и 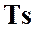 ─ диаграммах.
─ диаграммах.
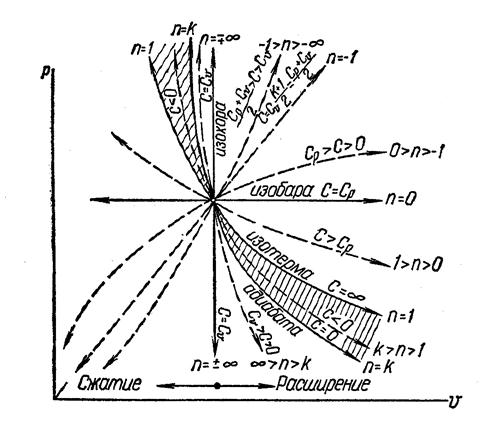 |
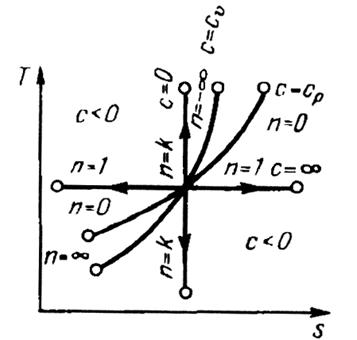 Рис. 5 Изображение основных процессов в
Рис. 5 Изображение основных процессов в 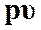 - диаграмме
- диаграмме
Рис. 6. Изображение основных термодинамических процессов
в 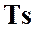 - диаграмме
- диаграмме
Все процессы начинаются в одной точке (в центре).
Изохора 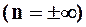 делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа.
делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа.
Процессы, расположенные правее и выше адиабаты, идут с подводом теплоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой 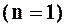 , характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
, характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную теплоемкость, так как 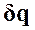 и
и 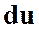 (а, следовательно, и
(а, следовательно, и 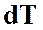 ), имеют в этой области противоположные знаки. В таких процессах
), имеют в этой области противоположные знаки. В таких процессах 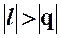 , поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
, поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
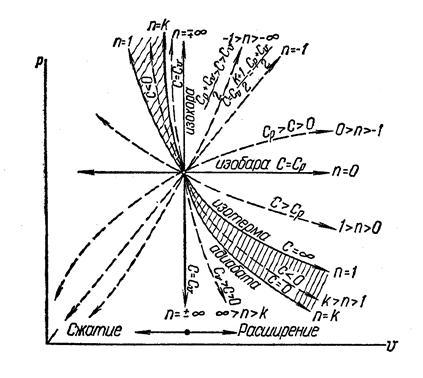
Рис. 5 Изображение основных процессов в  - диаграмме
- диаграмме
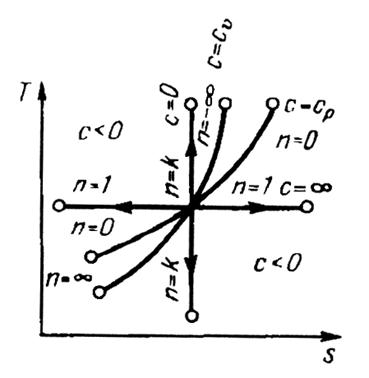 |
Рис. 6. Изображение основных термодинамических процессов в  - диаграмме
- диаграмме
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1574; Нарушение авторских прав?; Мы поможем в написании вашей работы!