
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Титановые руды
|
|
|
|
Титан — металл серебристого цвета с голубоватым отливом; имеет невысокую плотность 4,507 г/см8, плавится при температуре 1660 °С, кипит при 3260 °С. Титан имеет две аллотропические модификации; до 882 °С существует а-титан, имеющий гексагональную решетку с параметрами а0 = 0,295 нм и С0 = 0,468 нм, и при более высоких температурах — β-титан с кубической объемно центрированной решеткой с параметром а = 0,304 нм.
Механические свойства титана изменяются от содержания в нем примесей. Чистый титан ковок, имеет невысокую твердость (НВ 70); технический титан хрупок и тверд (НВ 180—280).
Вредные примеси титана — азот и кислород резко снижают его пластичность, а углерод при содержании более 0,15 % снижает ковкость, затрудняет обработку титана резанием и резко ухудшает свариваемость. Водород в большой степени повышает чувствительность титана к надрезу, поэтому этот эффект называют водородной хрупкостью.
На поверхности титана образуется стойкая оксидная пленка, вследствие чего титан обладает высокой сопротивляемостью коррозии в некоторых кислотах, морской и пресной воде. На воздухе титан устойчив и мало изменяет свои механические свойства при нагреве до 400 °С. При более высоком нагреве он начинает поглощать кислород, ухудшаются его механические свойства, а выше 540 °С—становится хрупким. При нагреве выше 800 °С титан энергично поглощает кислород, азот и водород, что используется в металлургии при производстве легированной стали.
Титан образует ряд оксидов. Из них наиболее изучены TiO2, Ti2O3. Двуокись титана ТіО2—амфотерный порошок белого цвета, практически не растворимый в воде и разбавленных кислотах. Двуокись титана является основным продуктом переработки титанового сырья.
За последние десятилетия после промышленного освоения ковкого титана его стали широко использовать как прочный, относительно легкий коррозионно-стойкий и жаропрочный конструкционный материал в самолетостроении, ракетостроении, при производстве реактивных двигателей. Он получил признание и в судостроении благодаря его устойчивости против воздействия морской
воды.
По распространенности в земной коре титан занимает десятое место среди других элементов (0,61 %). Известно примерно 60 минералов титана, из них наибольшее промышленное значение имеют ильменит, рутил, сфен.
Ильменит FeO-ТіО2 впервые был найден на Урале в Ильменских горах, откуда и получил свое название. Это блестящий минерал буро-черного цвета, измельчающийся при выветривании и поэтому часто встречающийся в россыпях. Важным источником ильменита служат титаномагнетитовые железные руды — смеси ильменита с магнетитом Fе3О4 и частично с гематитом Fе2О3. В этих рудах содержание двуокиси титана достигает иногда 20 %. Титаномагнетитовые руды можно подвергать гравитационному и магнитному обогащению, в результате чего удается получать концентрат, содержащий более 40 % TiO2, ~50 % оксидов железа и ~8 % других оксидов.
Рутил ТіО2 прозрачен, обладает алмазно-металлическим блеском, бывает окрашен в различные цвета (красно-коричневый, желтый, синий, черный). Крупные месторождения рутила встречаются редко.
Сфен (титанит) CaO -TiO2-SiO2 —титаносиликат кальция встречается вместе с другими полезными минералами — апатитом и нефелином и при условии комплексной переработки может быть перспективным сырьем, хотя он и беднее, чем ранее рассмотренные минералы.
Известно несколько различных способов получения титана из его руд, причем во всех случаях металлургической переработке всегда предшествует обогащение руды и получение концентрата.
§ 15. Поняття про виробництво титану
1. Титанові руди — це рутил ТіO2, ільменіт FeO · ТіО2 і титаномагнетит—суміш ільменіту з оксидами заліза Fе3O4 і (частково) Fе2О3. Титанові руди збагачують флотацією або магнітною сепарацією, внаслідок чого утворюється концентрат з високим вмістом оксиду титану (90—99% ТіО2).
Одним з основних способів добування металевого титану з оксидів є магнієтермічний, який складається з двох стадій:
вироблення чотирихлористого титану і виділення металевого титану.
2. Чотирихлористий титан виробляють відновленням ТіО2 і хлоруванням титану в хлораторі. Кожух 1 хлоратора (рис. 43, а) виготовляють з листової сталі і футерують ізсередини фасонною динасовою цеглою 2 з шамотним термоізоляційним шаром. Через бункер 6 у хлоратор завантажують брикети 5 пресованої суміші титанового концентрату ί деревянного вугілля (або графіту). Знизу через патрубок 4 в хлоратор надходить хлор. Процес хлорування відбувається при температурі 800— 850° С. Нагрівається хлоратор за допомогою нагрівальних графітових елементів 3 опору. В ньому відбувається реакція
ТіО2 + 2С + 2Сl2 = ТіСІ3 + 2СО.
Пара чотирихлористого титану TiCl4, що утворюється, трубопроводом 7 надходить у пилоочисник 8. а потім — у конденсатор 9, де перетворюється на рідину. Рідкий чотирихлористий титан після відстоювання надходить на дальше очищення — фільтрацію і дистиляцію.
3. Виділення металевого титану. З очищеного чотирихлористого титану відновлюють металевий титан. Цей процес ведуть у спеціальних ретортах (рис. 43, б). У стальний стакан 17 корпуса 11 реактора завантажують чушковий магній, герметично закривають кришкою 14, відкачують повітря з реактора і заповнюють простір очищеним аргоном. Потім за допомогою електронагрівника 12 реактор нагрівають до температури 800—850° С і подають у нього по трубі 13 чотирихлористий титан. Процес відновлення титану відбувається за реакцією ТіСІ4 (пара) + 2Mg (рідина) = Ті (тверде тіло) +2MgCl2 (рідина).
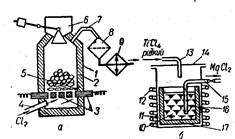
Рис. 43. Схема вироблення титану.
Металевий титан виділяється у вигляді губки 16, а хлористий магній 10 відсмоктується вакуум-насосом по трубопроводу 15. Після закінчення процесу реактор охолоджують і виймають стакан з титановою губкою. Губка містить значну кількість шкідливих домішок, тому її очищають вакуумною дистиляцією. Для цього стакан з губкою поміщають у спеціальний апарат, де утворюється вакуум і одночасно здійснюється нагрівання до температури 900—950° С. Це забезпечує видалення з пор губчастої маси залишків металевого і хлористого магнію. Після охолодження апарата стакан виймають і титанову губку відправляють на механічне дроблення. Потім подрібнену губку обробляють металокерамічним або іншими методами плавлення для того, щоб мати компактний титан.
Суть металокерамічного методу плавлення компактного титану полягає в тому, що титанові порошки пресують у заготовки і потім спікають у вакуумній печі при температурі 1050— 1100° С. Компактний титан виробляють також плавленням губки в електричних дугових печах з нейтральною атмосферою (в середовищі аргону) або у вакуумі. Для цього застосовують електродугові печі двох типів: 1) з постійним вольфрамовим електродом; 2) з пресованим електродом з титанової губки, який витрачається.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 592; Нарушение авторских прав?; Мы поможем в написании вашей работы!