
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
I Сущность химического равновесия
|
|
|
|
Химическое равновесие
Лекция 4
Тема химическое равновесие для студентов первого курса не новая. Но в школе равновесие проходят без количественной характеристики. Об этом нам и предстоит побеседовать сегодня.
Какая доля веществ реагирует до наступления равновесия? К ответу можно подойти, зная критерий самопроизвольного протекания процесса в закрытой системе: если D G < 0 (D G = - W ′), то возможен самопроизвольный процесс. От знака D G зависит направление процесса. При D G > 0 самопроизвольным оказывается обратный процесс. Остается случай D G = 0. Это состояние химического равновесия. Таким образом, равновесие это состояние, в котором система не может производить работу. Оно наступает в результате выравнивания скоростей прямой и обратной реакций. Численным значением D G определяется соотношение концентраций реагентов и продуктов реакции в состоянии равновесия. Учение о равновесии это часть термодинамики.
Коротко напомню. Есть обратимые реакции, протекающие одновременно в прямом и обратном направлении. Направление процесса в данной системе обнаруживается тем, концентрации каких веществ увеличиваются, а каких уменьшаются (стрелка вверх – увеличение, стрелка вниз – уменьшение).

 СН3СООН + Н2О СН3СОО- + Н3О+
СН3СООН + Н2О СН3СОО- + Н3О+
с уменьшаются (↓) увеличиваются (↑)
реакция идет вправо (прямая), Dr G < 0

 СН3СООН + Н2О СН3СОО- + Н3О+
СН3СООН + Н2О СН3СОО- + Н3О+
с увеличиваются (↑) уменьшаются (↓)
реакция идет влево (обратная), Dr G > 0
 СН3СООН + Н2О СН3СОО- + Н3О+
СН3СООН + Н2О СН3СОО- + Н3О+
с постоянны
состояние равновесия, Dr G = 0
Обратимых реакций, по-видимому, больше, чем необратимых. Необратимыми реакциями в газовой фазе являются реакции горения. В растворах обратимо большинство реакций. Пример необратимой реакции в растворе – гидролиз белков. Обычно приходится говорить о практической обратимости или необратимости реакций.
|
|
|
Реакция считается практически обратимой, если после ее окончания концентрация реагентов составляет более 0,001 от исходной величины. При этом Dr G находится в пределах приблизительно от –17 до –31 кДж/моль (в зависимости от стехиометрии реакции).
По мере протекания химической реакции, ее скорость в прямом направлении уменьшается, а в обратном увеличивается. Наступает состояние равновесия, в котором v пр = v обр. Концентрации веществ перестают изменяться, принимают постоянные значения равновесных концентраций, которые будем далее обозначать «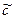 ».
».
Таким образом, состояние равновесия носит динамический характер – превращение частиц в системе продолжается, идут как прямая, так и обратная реакции. Равновесием не является заторможенное состояние смеси веществ, когда в системе отсутствуют химические реакции, которые, судя по термодинамическим характеристикам, могли бы происходить: смесь водорода и кислорода, смесь газообразных углеводородов с воздухом, взрывчатые вещества, превращение глюкозы в молочную кислоту. В таких смесях процесс может быть инициирован извне (нагревание, облучение, внесение катализатора) и проходит практически необратимо.
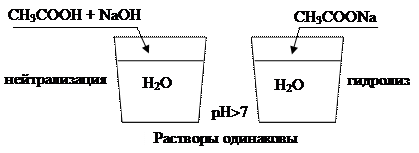
Химическое равновесие достигается как по прямой, так и по обратной реакциям. Взяв уксусную кислоту и гидроксид натрия в растворах, или ацетат натрия и воду, получим конечный раствор, содержащий эту соль с небольшой примесью уксусной кислоты и гидроксида натрия.

Наконец, катализатор не влияет на состояние равновесия. Если равновесие в системе достигнуто, то катализатор себя не проявляет. Если в системе реакция идет медленно, или даже имеется полностью заторможенное состояние, то катализатор ускоряет достижение равновесия.
|
|
|
В окружающей действительности наиболее обычны необратимые процессы, в том числе, и в организме человека. Однако необратимые реакции в организме протекают в определенных условиях, создаваемых быстрыми обратимыми реакциями. Среди них хорошо известны реакции переноса протона, в которых особенно быстро достигается состояние равновесия. Постоянство рН – результат обратимых кислотно-основных реакций.
II Количественная характеристика равновесия.
Нам будет необходимо понятие химического потенциала m.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 775; Нарушение авторских прав?; Мы поможем в написании вашей работы!