
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Темп химических превращений
|
|
|
|
Мы почти не задумываясь скажем, что натрий с водой реагирует быстро, а розовый раствор перманганата калия разлагается и выделяет бурый осадок оксида марганца(IV) довольно медленно. Масляная краска на скамейке в парке засыхает дня за 2, а индикатор в колбочке для титрования меняет окраску в ту же секунду, как добавлен титрант. Как можно было бы количественно охарактеризовать темп химических превращений? Есть две наиболее распространенные характеристики: период (время) превращения и скорость. Количество исходного вещества убывает во времени, как правило, с замедлением. Весь период полного превращения неопределенно растягивается. Поэтому принято в качестве характеристики использовать период полупревращения t ½ – время, за которое количество или концентрация исходного вещества уменьшается в 2 раза (на 50%). Таким способом характеризуют распад радионуклидов, так как период их полупревращения не зависит от исходного количества. Постоянством периода полупревращения (при данной температуре) характеризуются и реакции разложения, и вообще реакции первого порядка.
Более точная характеристика – скорость, или производная концентрации по времени
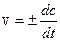 ; единица измерения скорости реакции
; единица измерения скорости реакции
моль·л–1·с–1.
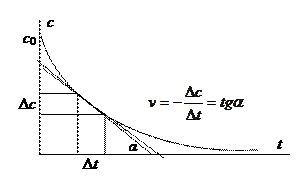
Пример: реакция Н2 + I2 = 2HI
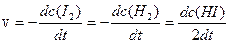
Часто вычисляют среднюю скорость v = ± D c /D t
От чего зависит скорость реакций? Можно сказать, что имеются 3 главных фактора – механический (частота столкновений частиц), физический (температура) и химический (катализ). Эти факторы действуют как в гомогенных, так и в гетерогенных реакциях.
Гомогенные реакции (реагирующие вещества в одной фазе, реакция идет в объеме): концентрация, температура, катализаторы
Гетерогенные реакции (реагирующие вещества в разных фазах, реакция идет на поверхности): концентрация, температура, катализаторы, поверхность соприкосновения, перемешивание, объем системы. Последние 2 фактора выявляются в примерах из жизни: перемешивание сахара в чашке с чаем и нехватка кислорода в тесном помещении.

3. Зависимость скорости реакции от концентрации.
Реакции идут через столкновения частиц, частота которых зависит от концентраций. Отсюда вытекает зависимость скорости от концентрации. Вместе с тем, реально реакции идут через бимолекулярные столкновения, и лишь в редчайших случаях через тройные столкновения. Поэтому в большинстве реакций превращения исходных веществ в продукты являются многостадийными процессами.
С3Н8 + 5О2 = 3СО2 + 4Н2О – не в одну же стадию идет эта реакция!
H2 + I2 = 2HI – простая бимолекулярная
2NO + Cl2 = 2NOCl – простая тримолекулярная (и то под вопросом)
H2O2 + 2HI = 2H2O + I2 – сложная (доказано)
N2O4 = 2NO2 – мономолекулярная
Стадия реакции – совокупность одинаковых элементарных превращений (элементарных актов).
Механизм реакции – совокупность последовательных стадий.
Простая реакция – реакция, проходящая в одну стадию.
Сложная реакция – реакция протекающая не менее чем в две последовательные стадии.
Молекулярность реакции – число частиц в единичном столкновении. Почти всегда два.
Закон действующих масс: Скорость простой химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях n.
Имеется аналогия с ЗДМ в равновесии, но надо обратить внимание на различия.
В выражении ЗДМ для равновесия показатели степени всегда равны стехиометрическим коэффициентам.
Константа равновесия может быть рассчитана по термодинамическим данным о веществах. Константа скорости определяется только экспериментально.
В мономолекулярной реакции A ® продукты
v = k × c (A)
В бимолекулярной реакции A + В ® продукты
v = k × c (A)× c (В)
В бимолекулярной реакции 2A ® продукты
v = k × c 2(A)
В тримолекулярной реакции 2A + В ® продукты
v = k × c 2(A)× c (В)
Это все возможные варианты кинетических уравнений простых реакций. В этих реакциях k – константа скорости, не зависящая от концентраций, но зависящая от температуры. Каждая реакция характеризуется своей константой скорости. От ее величины в основном и зависит скорость, так как реальный диапазон изменения концентраций не столь велик, как диапазон изменения констант скорости у разных реакций.
В сложных реакциях сочетание элементарных бимолекулярных стадий дает в результате непредсказуемые зависимости скорости от концентраций. На основе данных эксперимента их можно представить в виде
v = k × c а(A)× c в(В) …,
где показатели степени могут совпадать, но могут и не совпадать со стехиометрическими коэффициентами.
Показатели степени в кинетическом уравнении называют порядком реакции по соответствующему веществу (частным порядком). Порядок может быть дробным, и даже нулевым. Сумма показателей степени носит название «порядок кинетического уравнения».
Скорость реакции
H2O2 + 2HI = 2H2O + I2
определяется кинетическим уравнением второго порядка
v = k × c (H2O2)× c (HI).
Показатель степени при концентрации иодоводорода не совпадает со стехиометрическим коэффициентом 2. Это означает, что реакция идет по сложному механизму не менее чем в 2 стадии.
1) H2O2 + HI = H2O + HIO, медленная стадия;
2) HIO + HI = H2O + I2, быстрая стадия.
Скорость образования конечного продукта I2 определяется первой медленной стадией, отчего и кинетическое уравнение реакции совпадает с кинетическим уравнением1-й стадии.
При изучении кинетики реакций определяется концентрация вещества в последовательные моменты времени – кинетическая кривая. Из этих данных выводятся кинетические уравнения. Рассмотрим взаимосвязь между порядком реакции и характером изменения концентрации во времени. Для этого кинетические уравнения интегрируются.
Первый порядок: А → продукт
v = k × c (A) или 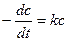 ;
;
разделяем переменные: 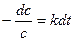 .
.
Интегрирование этого дифференциального уравнения дает
с = с оexp(– kt) или в логарифмической форме
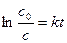
Отсюда можно вывести формулу для периода полупревращения реакции 1-го порядка:
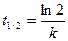
Из формулы очевидно, что период полупревращения реакции 1-го порядка не зависит от концентрации. За каждый период полупревращения реагирует половина наличного количества вещества.
Пример. Какая доля вещества останется через 3 периода полупревращения, если реакция идет по первому порядку?
Решение. За один период превращается 50% вещества, за второй еще 25%, за третий – еще 12,5%. Остаток составит 100% – 50% – 25% – 12,5% = 12,5%.
Можно вычислить результат по уравнению, приняв t = 3 t ½.
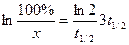 ;
; 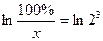 ;
; 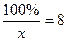 ; х = 12.5%
; х = 12.5%
Результаты математических выводов для реакций 1-го и 2-го порядка и важных в ферментативном катализе реакций нулевого порядка представим в таблице:
| Поря- док | v = | Единица измерения k | c = | t 1/2 = | Линейная функция времени |
| 1-й | kc | с–1 | с оexp(– kt) | 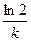
| ln c |
| 2-й | kc 2 | л×моль–1×с–1 | 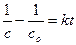
| 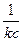
| 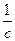
|
| 0-й | k | моль×л–1×с–1 | с о - kt | 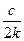
| c |
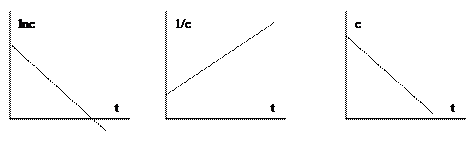
Установив по данным эксперимента, какая зависимость имеет линейный характер, можно сделать вывод о порядке реакции.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 608; Нарушение авторских прав?; Мы поможем в написании вашей работы!