
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач
|
|
|
|
СТРОЕНИЕ АТОМОВ
Современная теория строения атомов и молекул базируется на законах движения микрочастиц, обладающих очень малой массой, порядка 10-27 – 10-31 кг. Эти законы были сформулированы в 1923-27 годах и привели к созданию новой науки – квантовой механики. Установлено, что поведение микрочастиц принципиально отличается от поведения микрообъектов, изучаемых классической механикой.
Применение законов квантовой механики к химическим явлениям привело к созданию квантовой химии, которая является основой современной теории химической связи и строения вещества.
Движение электрона в атоме имеет вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,9-0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, m1). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер (n), форму (l) и ориентацию (m1) атомной орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму. Формы электронных облаков аналогичны АО. Их также называют электронными или атомными орбиталями. Электронное облако характеризуется четырьмя числами (n, l, ml, и ms). Эти квантовые числа связаны с физическими свойствами электрона, и число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число l (орбитальное) – момент количества движения (энергетический подуровень), число m1 (магнитное) – магнитный момент, ms – спин. Спин электрона возникает за счет вращения его вокруг собственной оси. Электроны и атомы должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому на АО могут находиться не более двух электронов, различающихся своими спинами ms = ± 1/2. Заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n + l, а при равной сумме – в порядке возрастания числа n. Соответственно по этому правилу последовательность заполнения энергетических уровней и подуровней следующая:
1s2 < 2s2 < 2p6 < 3s2 < 3p6 < 4s2 < 3d10 < 4p6 < 5s2 < 4d10 < 5p6 < 6s2
< 5d1 < 4f14 < 5d9 < 6p6 < 7s2 < 6d1 < 5f14 < 6d9 < 7p6 < 8s2……
Пример 1. Напишите электронную формулу атома серы. К какому электронному семейству относится сера? Укажите валентные электроны, распределите их по энергетическим ячейкам в нормальном и возбужденных состояниях.
Решение. У атома серы порядковый номер 16 в таблице Д.И. Менделеева, поэтому – 16 электронов и последовательность заполнения энергетических уровней и подуровней совпадает с электронной формулой (что характерно для элементов с порядковыми номерами от 1 до 20):
16S – 1s2 2s2 2p6 3s2 3p4
Последним заполняется p-подуровень, поэтому сера принадлежит к p-электронному семейству; содержит 6 валентных электронов – 3s2 3p4. Представим схему размещения валентных электронов в квантовых (энергетических) ячейках:







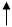


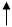



 3s 3p 3d
3s 3p 3d
16S -...
 Валентность серы в нормальном состоянии равна 2, например, в соединениях H2S, Na2S, CaS.
Валентность серы в нормальном состоянии равна 2, например, в соединениях H2S, Na2S, CaS.
У атома серы на 3d-подуровне имеются вакантные орбитали. При возбуждении атома происходит разъединение пар электронов и переход их на свободные орбитали.
Представим электронные конфигурации атома серы в возбужденных состояниях:
3s 3р 3d














 а) 16S* - …, 16S* - … 3s23p33d1
а) 16S* - …, 16S* - … 3s23p33d1
Валентность серы равна 4, например, в соединениях SO2, H2SO3
3s 3p 3d














 б) 16S*- … S* - … 3s1 3p3 3d2
б) 16S*- … S* - … 3s1 3p3 3d2
Валентность серы равна 6, например, в соединениях: SO3, H2SO4.
Вывод: валентность серы в соединениях 2, 4, 6.
Пример 2. Составьте электронную формулу атома титана и ионов титана Ti2+ и Ti4+. К какому электронному семейству относится титан? Приведите электронные аналоги титана.
Решение. Порядок заполнения энергетических уровней и подуровней следующий:
22Ti – 1s2 2s2 2p6 3s2 3p6 4s2 3d2
Титан принадлежит к d-электронному семейству.
Электронная формула титана имеет вид:
22Ti – 1s2 2s2 2p6 3s2 3p6 3d2 4s2
Подчеркнуты валентные электроны.
Электронно-графические формулы валентных электронов атома титана в нормальном и возбужденном состояниях:
3d 4s 4p 4d 4f

















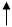






 22 Ti -…
22 Ti -…
Валентность титана в нормальном состоянии равна 2, например, в соединениях: TiO, TiCl2. Такая валентность обусловлена двумя неспаренными электронами, но вакантные орбитали на 4p-подуровне вносят дополнительный вклад в валентность и титан в некоторых соединениях проявляет валентность, равную 3, например, в соединении TiCl3.
При возбуждении атома титана происходит распаривание 4s-электронов и переход их на 4p-подуровень, валентность титана в этом состоянии равна 4 (TiO2, TiCl4):
3d 4s 4p 4d 4f
























 22Ti*-…
22Ti*-…
22 Ti* - … 3d2 4s1 4p1 4d0 4f0
Сокращенная электронная формула атома титана:
22 Ti - … 3d2 4s2
Электронные аналоги титана:
40 Zr - … 4d2 5s2; 72 Hf - …5d2 6s2
Электронные формулы ионов титана Ti2+ и Ti4+ соответственно:
22Ti2+ - … 3d2 4s0; 22Ti4+ - … 3d0 4s0.
Пример 3. Для атома с электронной структурой 1s22s22p1 найдите значения четырех квантовых чисел n, l, ml, ms, определяющие каждый из электронов в нормальной состоянии.
Решение. Электронную формулу1s22s22p1 имеет атом бора. Значения квантовых чисел для электронов атома бора надо определять с учетом принципа Паули, согласно которому в атоме не может быть даже двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
1-й энергетический уровень атома бора содержит два электрона в s-состоянии. Эти электроны характеризуются следующим набором квантовых чисел: 1,0, 0, ± ½.
Электроны в s-состоянии второго энергетического уровня имеют значения квантовых чисел: 2,0, 0, ± 1/2.
Электроны в р-состоянии второго энергетического уровня имеют значения квантовых чисел: 2, 1, -1, + 1/2.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 2904; Нарушение авторских прав?; Мы поможем в написании вашей работы!