
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач. Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
|
|
|
|
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
2NО (г) +О2 (г) ↔ 2NО2 (г), если объем газовой смеси уменьшить в три раза?
Решение. Обозначим концентрации реагирующих веществ: 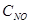 =а,
=а,  =b,
=b, 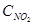 =с. Согласно закону действия масс скорости (v) прямой и обратной реакции до изменения объема
=с. Согласно закону действия масс скорости (v) прямой и обратной реакции до изменения объема
vпр.= kпр.а2b; vобр. = kобр.c2;
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: 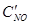 =За,
=За, 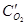 =3b,
=3b, 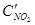 =3с. При новых концентрациях скорости (v’) прямой и обратной реакции:
=3с. При новых концентрациях скорости (v’) прямой и обратной реакции:
 = kпр. (За)2 (3b) = 27kпр.а2b;
= kпр. (За)2 (3b) = 27kпр.а2b;
 = kобр. (3с)2 = 9kобр.c2.
= kобр. (3с)2 = 9kобр.c2.
Отсюда 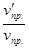 =
=  = 27;
= 27; 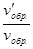 =
= 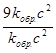 = 9.
= 9.
Следовательно, скорость прямой реакции увеличилась,. в 27 раз, а обратной — в 9 раз.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 50 до 70°С, если температурный коэффициент реакции равен 3.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
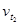 =
= 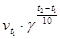 ;
;
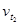 =
= 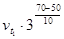 =
=  = 9
= 9 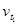 .
.
Следовательно, скорость реакции (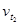 ), протекающей при температуре 70°С, увеличилась по сравнению со скоростью реакции (
), протекающей при температуре 70°С, увеличилась по сравнению со скоростью реакции (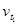 ), протекающей при температуре 50°С, в 9 раз.
), протекающей при температуре 50°С, в 9 раз.
Пример 3. Энергия активации реакции равна 33кДж/моль. Во сколько раз увеличится скорость реакции при нагревании реакционной смеси с 25 до 60оС?
Решение. Зависимость константы скорости химической реакции от температуры определяется уравнением Аррениуса:
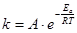 ,
,
где Еа - энергия активации реакции;
А - константа для данной реакции.
Записав выражения для констант скорости данной реакции k2 и k1 при температурах соответственно Т2 и Т1 и разделив первое уравнение на второе, получим: 
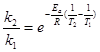 или
или 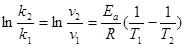
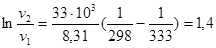 отсюда
отсюда 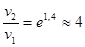 ,
,
т.е. скорость данной реакции увеличится в 4 раза.
Пример 4. Начальные концентрации исходных веществ в реакции
СН4 (г) +2Н2S(г) → CS2(г),+ 4H2(г)
были равны 0,3моль/л СН4 и 0,5моль/л Н2S. Найдите концентрации этих веществ в тот момент, когда образовалось 0,16 моль/л Н2. Как изменилась при этом скорость реакции?
Решение. По закону действия масс скорость данной реакции описывается уравнением:
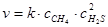
Начальная скорость реакции равна:
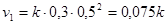 ,
,
где - константа скорости реакции, не зависящая от концентраций ее участников.
В начальный момент времени продукты реакции отсутствовали, т.е.начальные концентрации CS2 и H2 были равны 0. Расчет по уравнению реакции:
х у 0,16моль
СН4 (г) +2Н2S(г) → CS2(г),+ 4H2(г)
1моль 2моль 4моль
дает, что на образование 0,16 моль Н2 должно расходоваться
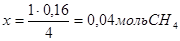 и
и 
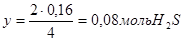
Поэтому к тому моменту, когда в системе образуется 0,16моль Н2, концентрации исходных веществ уменьшатся и составят: 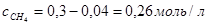
и 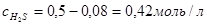
Соответственно, скорость реакции к этому моменту также уменьшится и будет равна:
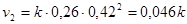
Отношение 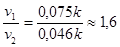 , т.е. скорость реакции уменьшится в 1,6 раза.
, т.е. скорость реакции уменьшится в 1,6 раза.
8. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 1338; Нарушение авторских прав?; Мы поможем в написании вашей работы!