
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. В насыщенном растворе сульфата свинца существует гетерогенное равновесие:
|
|
|
|
Решение.
В насыщенном растворе сульфата свинца существует гетерогенное равновесие:
РbSО4 (т)↔ Рb2+(р-р) + SО42-(р-р)
х х х
ПР(РbSО4)= 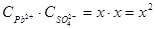
Растворимость бинарного электролита равна молярной концентрации каждого из его ионов: s= х =  =
=  1,5 10-4 моль/л. Растворимость соли, выраженная массовой концентрацией, равна s∙М= 1,5 ·10-4 моль/л ·303 г/моль = 0,0455 г/л.
1,5 10-4 моль/л. Растворимость соли, выраженная массовой концентрацией, равна s∙М= 1,5 ·10-4 моль/л ·303 г/моль = 0,0455 г/л.
Пример 2. Составьте уравнения реакций, протекающих в водных растворах, в молекулярной, ионной и сокращенной ионной формах: 1) между сульфидом натрия и сульфатом меди (II), 2) между гидроксидом железа (III) и соляной кислотой.
Решение задачи разобьем на этапы:
а) составляем уравнение реакции в молекулярной форме:
Na2S + CuSO4 = CuS↓ + Na2SO4
б) составляем уравнение реакции в ионной форме, изобразив формулы растворимых сильных электролитов в виде ионов, на которые они диссоциируют практически полностью, а формулы остальных веществ (например, выпадающих в осадок или слабых электролитов) оставим без изменения:
2 Na+ +S2- + Cu2+ + SO42- = CuS↓ + 2Na+ + SO42-
в) исключаем из правой и левой частей одинаковые количества одноименных ионов (они подчеркнуты);
г) записываем уравнение в сокращенной ионной форме:
S2- + Cu2+ = CuS↓
2. а) составляем уравнение реакции в молекулярной форме:
Fe(OH)3 + 3 HCl = FeCl3 + 3H2O
б) составляем уравнение реакции в ионной форме, оставляя в виде молекул труднорастворимый гидроксид железа и воду, являющуюся слабым электролитом:
Fe(OH)3 ↓ + 3 H+ + 3 Cl- = Fe3+ + 3 Cl- + 3H2O
в) исключаем из правой и левой частей одинаковые количества одноименных ионов (они подчеркнуты);
г) записываем уравнение в сокращенной ионной форме:
Fe(OH)3 ↓ + 3 H+ + = Fe3+ + 3H2O
Пример 3. Вычислите концентрацию ионов СН3СОО- в растворе, 1 л которого содержит 0,1 моль СН3СООН и 0,2 моль НCl, считая диссоциацию HCl полной.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 1002; Нарушение авторских прав?; Мы поможем в написании вашей работы!