
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория растворов
|
|
|
|
В середине XIX века общепринятой считалась физическая теория растворов, одним из авторов которой являлся Вант-Гофф (Голландия). Эта теория рассматривала растворы как механические смеси, без учета взаимодействий между молекулами растворителя и частицами растворенного вещества.
Факты, которые не могла объяснить физическая теория растворов:
1) Тепловые эффекты растворения.
Пример. Растворение 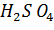 – процесс экзотермический; растворение
– процесс экзотермический; растворение  – эндотермический.
– эндотермический.
2) Изменение (чаще – уменьшение) объема жидкости при растворении. Это явление называется контракция.
Пример. При смешивании 50 мл 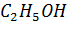 и 50 мл
и 50 мл 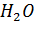 образуется 98 мл раствора
образуется 98 мл раствора
3) Изменение окраски некоторых веществ при растворении и некоторых растворов при выпаривании.
Примеры. Безводный сульфат меди(II) – белый порошок – при поглощении воды синеет.
Розовый раствор хлорида кобальта(II) при высыхании окраску не изменяет, а при последующем выпаривании – синеет.
1),2),3) - признаки химических реакций.
Д. И. Менделеев считал, что рассмотренные явления, безусловно, указывают на какие-то взаимодействия между растворенным веществом и растворителем. Он последовательно развивал мысль о химическом взаимодействии между частицами растворенного вещества и молекулами растворителя. Учение Менделеева было развито и дополнено русскими учеными И. А. Каблуковым и В. А. Кистяковским. На основе этих представлений произошло объединение физической и химической точки зрения на растворы.
Основные положения современной физико-химической теории растворов сводятся к следующему.
1) Растворитель и растворенное вещество химически взаимодействуют между собой.
2) В результате взаимодействия образуются непрочные соединения, называемые сольватами, а сам процесс называется сольватацией. В частном случае, когда растворителем является вода, эти соединения называются гидратами, а процесс – гидратацией.
Сами растворы, а также большинство гидратов (сольватов), которые образуются при растворении, имеют переменный состав. Этим они отличаются от химических соединений.
Физико-химическая теория растворов позволила объяснить многие непонятные до этого факты:
1) Изменение окраски некоторых веществ при растворении и некоторых растворов при выпаривании.
2) Тепловые эффекты при растворении.
Явление гидратации иногда можно наблюдать, не пользуясь специальными приборами. Например, безводный сульфат меди (II) CuSO4 – белое вещество. При его растворении в воде образуется голубой раствор. Окраска раствора обусловливается гидратированными ионами меди. Гидратированные частички иногда настолько прочны, что при выделении растворенного вещества из раствора в твердую фазу молекулы воды входят в состав кристаллов. Так, при выпаривании водного раствора сульфата меди в твердую фазу выделяется соль CuSO4∙5H2O.
Кристаллические вещества, в состав которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода - кристаллизационной
Аналогично объясняется изменение окраски раствора хлорида кобальта(II) при выпаривании. Гидратированные ионы кобальта в растворе - розового цвета, такой же розовый цвет имеет и кристаллогидрат кобальта (II) CoCl2∙6H2O. Но при прокаливании на воздухе кристаллогидрат кобальта теряет кристаллизационную воду и превращается в безводный хлорид кобальта(II) синего цвета.
Образованием кристаллогидратов объясняются и тепловые эффекты при растворении. Тепловой эффект растворения складывается из энергии, затраченной на разрушение кристаллической решетки и отделение частиц растворенного вещества друг от друга, а также энергии, которая выделяется при гидратации.
Какой вклад энергии преобладает, такой тепловой эффект в итоге мы и получаем.
Изменение других термодинамических параметров при растворении.
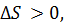 так как, в целом, при растворении беспорядок в системе увеличивается.
так как, в целом, при растворении беспорядок в системе увеличивается.
 так как растворение – процесс самопроизвольный.
так как растворение – процесс самопроизвольный.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 2490; Нарушение авторских прав?; Мы поможем в написании вашей работы!