
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворимость. Произведение растворимости
|
|
|
|
Равновесие в системе, состоящей из двух и более фаз, называется гетерогенным. Если одной фазой системы является твердое малорастворимое вещество, например, соль CnAm, а другой фазой – насыщенный жидкий водный раствор ее, то в системе устанавливается равновесие:
СnAm(тв) ↔ nCm+(р-р) + mAn−(р-р),
где n – число катионов Cm+ с зарядом m+; m – число анионов An− с зарядом n−.
Для этого процесса константа химического равновесия имеет выражение:
 ,
,
где a − активности катиона (+) и аниона (−) в растворе и твердой соли. Так как активность индивидуального твердого вещества равна единице (или постоянна при T=const), то ее можно объединить с Ke, а новую постоянную называют произведением активностей или произведением растворимости SP:
 .
.
SP зависит от природы вещества и температуры, но не зависит от активности ионов этого вещества.
Связь растворимости S с произведением растворимости SP
Растворимостью называют явление, способность, образование относительно однородной смеси двух и более компонентов. Под растворимостью также понимают концентрацию насыщенного раствора. До сих пор используются Таблицы растворимости, в которых вещества условно разделены на растворимые (растворимость > 10 г/л обозначена буквой Р), малорастворимые (растворимость 0,01÷10 г/л обозначена буквой М) и нерастворимые (растворимость< 0,01 г/л обозначена буквой Н). Очевидно, что это более, чем формально, так как во многих случаях аналитики имеют дело с растворами, содержащими много меньше 00,1 г изучаемого объекта в литре.
Предполагаем, что ионизация (диссоциация) полная, тогда растворимость как концентрация насыщенного раствора S определяет концентрацию и активности ионов в нем. Представим активность в виде произведения концентрации ионов с на коэффициент активности γ и учтем, что концентрации катионов и анионов в n и m раз больше растворимости S
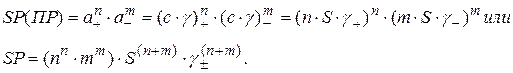
В формулу введен среднеионный коэффициент активности в виде:
 .
.
Именно γ±, а не коэффициенты активности отдельных ионов можно определить экспериментально или рассчитать.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 166; Нарушение авторских прав?; Мы поможем в написании вашей работы!