
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферные системы
|
|
|
|
Buffer в буквальном переводе означает нечто, что уменьшает воздействие на систему внешней силы. В отношении растворов − это системы, способные сохранять, примерно, постоянную концентрацию ионов H+ при добавлении небольших количеств кислоты или щелочи, а также при разбавлении.
Такими буферирующими свойствами обладают смеси:
1. Cлабая кислота + ee соль сильного основания, например,
СН3СООН + СН3СООNa − ацетатный буфер (рН ~ 5);
2. Слабое основание + его соль сильной кислоты, например,
NH3 . H2O + NH4Cl − аммиачный буфер (рН ~ 9);
3. Смесь двух кислых разнозамещенных солей многоосновной кислоты, например, Na2HPO4 + KH2PO4 − фосфатный буфер (рН ~ 7);
4. Индивидуальная соль, например,
Na2B4O7 . 10H2O, рН~9;
5. Концентрированные растворы сильных кислот и щелочей.
Рассмотрим более подробно ацетатный буфер: уксусная кислота – слабый электпролит, ацетат натрия (соль) – сильный электролит.
СН3СООН ↔ СН3СОО− + Н+,
СН3СООNa → СН3СОО− + Na+.
Напишем выражение для константы ионизации слабой кислоты Kia и учтем, что в смеси концентрация ацетат аниона практически равна концентрации соли сs, а концентрация непроионизировавших молекул – концентрации кислоты ca
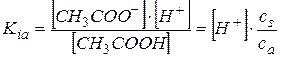 .
.
Выразим [H+] и pH:
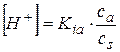 ,
, 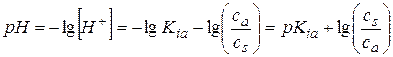 .
.
Из полученного уравнения Henderson-Hasselbalch следует, что pH такой буферной смеси определяется значением pKia и соотношением концентраций соли и кислоты. Если cs=ca, то pH = pKia и для ацетатного буфера pH = 4,76.
Рассуждая аналогично, получим для аммиачного буфера:
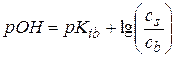 ,
, 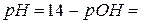
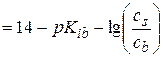 ,
,
где Kib и cb – константа ионизации и концентрация слабого основания смеси соответственно. Если cs=cb, то pH=14− pKib и для аммиачного буфера pH=14−4,75=9,25.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 744; Нарушение авторских прав?; Мы поможем в написании вашей работы!