
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа гидролиза, степень гидролиза
|
|
|
|
Ступенчатый гидролиз
Ступенчатому гидролизу подвергаются соли, образованные многоосновными слабыми кислотами или многоосновными слабыми основаниями.
Гидролиз по аниону (pH>7).
Na2CO3 + HOH ↔NaHCO3+ NaOH – первая ступень,
NaHCO3+ HOH ↔ H2CO3 + NaOH – вторая ступень.
Гидролиз по катиону (pH<7).
AlCl3 + HOH ↔ AlOHCl2 + HCl – первая ступень,
АlOHCl2 +H2O ↔ Al(OH)2Cl + HCl – вторая ступень,
Al(OH)2Cl + HOH ↔ Al(OH)3 + HCl – третья ступень (очень мало).
Гидролиз – как правило, обратимый процесс не идущий до конца.
Необратимый гидролиз – если продукты уходят из реакции (↓и↑).
Al2S3 + 6H2O = 2Al(OH)3↓+3H2S↑
Обратной гидролизу является реакция нейтрализации
CH3COO– + HOH ↔ CH3COOH+ OH–.
Подавление и усиление гидролиза
Для усиления гидролиза соли, гидролизующейся по катиону, необходимо добавить основание для связывали ионов Н+
Кt+ + HOH ↔ KtOH +H+
При добавлении кислоты в этом случае гидролиз подавляется. Принцип управления гидролизом соли, образованной слабой кислотой, аналогичен:
An– + HOH ↔ AnH + OH–.
Для усиления – добавляют кислоту, для уменьшения – основание. Катионы водорода можно связать в кислые анионы (HCO–3) или в нейтральные молекулы слабых кислот (H2CO3), действуя на растворы солями сильных оснований слабых кислот, например, Na2CO3.Анионы можно связывать в комплексные ионы, например,
[Co(OH)]+, [Al(OH)2]+.
Константу гидролиза Kh и степень гидролиза  используют для количественной оценки гидролиза. Степень гидролиза – доля гидролизованных молекул: отношение концентрации (числа) гидролизованных Ch к начальной концентрации (числу) молекул С0. По смыслу это аналогично понятиям степень диссоциации, ионизации, превращения
используют для количественной оценки гидролиза. Степень гидролиза – доля гидролизованных молекул: отношение концентрации (числа) гидролизованных Ch к начальной концентрации (числу) молекул С0. По смыслу это аналогично понятиям степень диссоциации, ионизации, превращения
 .
.
Рассмотрим случай гидролиза по аниону.
KCN +HOH ↔ HCN + KOH или в ионном виде
СN¯ + HOH ↔ HCN + OH¯
Константа химической реакции для этого процесса
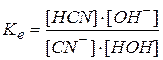 .
.
В разбавленных растворах вода находится в большом избытке, ее концентрация практически не меняется при смещении равновесия гидролиза и, как постоянную величину, [ HOH ] объединяют с Ke в константу, называемую константой гидролиза Kh:
Kh = Ke · [ HOH ] = 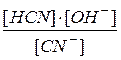 .
.
Умножив числитель и знаменатель на [H+], получим:
Kh =  , где
, где
Kw – ионное произведение воды, Kia(HCN) – константа ионизации слабой (синильной) кислоты.
Концентрация гидролизованных мол-л C0 .αh, а негидролизованных
С0 -C0 .αh = C0 (1-αh). Тогда для электролита типа (1-1):
Kh = 
 .
.
Если в знаменателе можно пренебречь αh по сравнению с единицей, то:
 .
.
Можно оценить pH раствора:
[OH–] = Co.αh = 
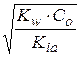 ; [H+] =
; [H+] =  =
=  ;
;
pH = -lg[H+] = -lg  .
.
Например, для 0,1 М раствора KCN, зная, что Kia (HCN)= 4,9·10-10,
pH=-lg 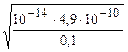 = 11,2 – сильно щелочной раствор.
= 11,2 – сильно щелочной раствор.
Аналогично рассуждая, можно вывести формулы для расчета Kh, αh, pH для других типов гидролизующихся солей.
Гидролиз по катиону (NH4Cl):
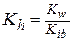 ,
,  , pH =
, pH =  ,
,
где Kib – константа ионизации слабого основания. Например, для 0,1 М раствора NH4Cl, зная, что  = 1,77·10-5 , получим значения
= 1,77·10-5 , получим значения
Kh=  =5,65ּ10-10; αh =
=5,65ּ10-10; αh =  =7,52ּ10-5;
=7,52ּ10-5; 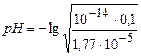 =
=
=5,12 – слабокислая среда.
Гидролиз по катиону и аниону (NH4CH3COO):
 ;
;  ,
,
где 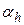 - значительная величина и ею нельзя пренебрегать по сравнению с единицей.
- значительная величина и ею нельзя пренебрегать по сравнению с единицей.
Гидролиз солей, образованных многоосновными кислотами или основаниями, протекающий в основном по первой ступени, описывается более сложными выражениями.
|
|
|
Дата добавления: 2017-01-14; Просмотров: 1652; Нарушение авторских прав?; Мы поможем в написании вашей работы!