
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение равновесного состояния
|
|
|
|
Равновесное состояние может быть целенаправленно изменено варьированием температуры (1) и состава реакционной смеси (2).
(1) Для количественного осаждения свинца в виде PbI2 реакцию:
Pb2+ + 2I− ↔ PbI2↓
проводят при пониженной температуре, так как этот процесс экзотермический (ΔH < 0): уменьшение Т смещает равновесие вправо.
(2) Рассмотрим реакцию:
H2O + CO ↔ H2 + CO2.
При температуре ~ 850о C константа равновесия ее равна единице:
 .
.
Пусть смешали по 2 моля H2O и CO. В равновесной смеси появятся H2 и CO2 по x моль, на столько же (по уравнению) уменьшится количество H2O и CO:
Вещества H2O CO H2 CO2
Исходный состав (моль) 2 2 0 0
Равновесный состав (моль) 2- x 2- x x x.
Решив уравнение:
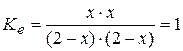
относительно x, получим состав равновесной смеси: по 1 молю всех участников (x =1). Если теперь увеличить количество H2O на 1 моль, то новое равновесное состояние будет отличаться от предыдущего тем, что количество H2 и CO2 возрастет до 1,2 моль, а CO уменьшится до 0,8.
Вещества H2O CO H2 CO2
Равновесный состав (моль) 1 1 1 1
Исходный состав (моль) 2 1 1 1
Равновесный состав (моль) 2- x 1- x 1+ x 1+ x.
Решив уравнение:

относительно x, получим состав:
Вещества H2O CO H2 CO2
Равновесный состав (моль) 1,8 0,8 1,2 1,2.
Следовательно, при добавлении воды степень превращения CO и выход продуктов увеличился – равновесие сместилось вправо. Того же результата можно достичь, если уменьшить количество любого продукта реакции. Очевидно, что обратные действия приведут к смещению равновесия влево.
Для смещения равновесия в прямом направлении необходимо использовать избыток исходных веществ и удалить продукты из зоны реакции (осаждением, выпариванием, дистилляцией, экстракцией, сорбцией). Для подавления реакции обычно в реакционную смесь добавляют продукты.
Равновесия в растворах электролитов
Проводниками будем называть вещества (материалы, смеси и т.д.), способные проводить электрический ток. В зависимости от природы частиц, переносящих электрический заряд, проводники можно разделить на электронные, ионные и со смешанной проводимостью (без учета дырочной), что показано на схеме 2 с некоторыми примерами.
В дальнейшем будем рассматривать лишь водные растворы кислот, оснований и солей.
Теория Аррениуса
Объяснение некоторых особенностей свойств растворов электролитов от неэлектролитов было дано Аррениусом. Оно касалось в первую очередь коллигативных свойств: понижения давления пара над раствором компонента по сравнению с давлением над чистыми веществами; повышения температуры кипения и понижения температуры замерзания раствора по сравнению с растворителем; осмотическое давление.
Положения теории Аррениуса (теории для слабых электролитов) следующие:
1. При растворении в воде молекулы веществ распадаются (диссоциируют, ионизируют) на заряженные частицы: положительные катионы (С) и отрицательные анионы (A):

где n и m – число катионов и анионов соответственно; m+ и n– ‑ их зарядовые числа (“заряды”).
Ионизация не связана с прохождением электрического тока через раствор.

2. Диссоциируют не все молекулы; часть их остается нераспавшимися. Степень диссоциации (ионизации) αi характеризует долю (или процент) распавшихся молекул:

где  ‑ число молекул (молей) i-го вещества “до” ионизации;
‑ число молекул (молей) i-го вещества “до” ионизации;
νi – равновесное число молекул (молей) i-го вещества “после” ионизации.
3. Между нераспавшимися молекулами и ионами устанавливается динамическое
ческое равновесие, которое можно описывать, как химическое равновесие, константой равновесия, называемой константой электролитической диссоциации (ионизации).
Выражение для концентрационной константы ионизации:
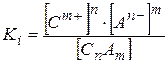 .
.
Степень ионизации, константа ионизации
Степень ионизации αi изменяется от 0 (для неэлектролитов) до 1
0 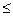 αi
αi 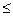 1 (100%).
1 (100%).
Это зависит от природы вещества, природы растворителя, концентрации и температуры.
При умеренных концентрациях (~ 0,1÷1,0 М) по значению αi все электролиты делят на сильные и слабые.
Для водных растворов к сильным электролитам (αi близка к единице) относят:
- сильные кислоты (HCl, HNO3, H2SO4),
- сильные основания (NaOH, KOH),
- большинство солей (NaCl, BaSO4, Cu(NO3)2, NaCH3COO).
К слабым электролитам (αi много меньше единицы, ~ 0,01) относят:
- слабые минеральные и органические кислоты (HCN, Н2СО3, H2S, CH3COOH, H2C2O4·2H2O),
- слабые минеральные и органические основания (NH3·H2O, CH3NH2·H2O, C6H5NH2·H2O),
- некоторые соли (HgCl2, Hg(CN)2, Fe(SCN)3, CdI2).
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 254; Нарушение авторских прав?; Мы поможем в написании вашей работы!