
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие – это такое состояние обратимого процесса
|
|
|
|
Химическое равновесие
На возможность двустороннего протекания химических превращений обратили внимание давно. Так, А.Лавуазье, установивший состав воздуха и воды, получил водород из воды (1783 г.), пропуская ее пары над раскаленным железом
3Fe + 4H2O  Fe3O4 + 4H2.
Fe3O4 + 4H2.
При той же температуре водород восстанавливает оксид до металла с образованием воды:
4H2 + Fe3O4  3Fe + 4H2O.
3Fe + 4H2O.
Наш соотечественник Н.Бекетов, изучая растворение мрамора в уксусной кислоте:
CaCO3 + 2CH3COOH ↔ Ca(CH3COO)2 + CO2↑ + H2O,
обнаружил, что при давлении CO2 равном 17 атмосферам растворение карбоната и выделение углекислого газа прекращается, а при Pco2 >17 атмосфер наблюдается выпадение осадка CaCO3.
Обратимые реакции используются и как аналитические, например:
KCl + NaHC4H4O6 ↔ KHC4H4O6↓ + HCl − открытие K+,
ZnCl2 + H2S ↔ ZnS↓ + 2HCl − открытие Zn2+,
2BaCl2 + K2Cr2O7 +H2O ↔ 2BaCrO4↓ + 2KCl +2HCl − открытие Ba2+,
AsO4 3− +2KJ + 2HCl ↔ AsO33− + J2 + 2KCl + H2O − восстановление As+5,
[CoCl4]2− + 6H2O ↔ [Co(H2O)6]2+ + 4Cl− − индикатор влажности.
∑riRi ↔∑piPi
(r, pi – стехиометрические коэффициенты, Ri, Pi – исходные вещества и продукты реакции соответственно для данной записи), при котором:
- скорость прямой реакции равна скорости обратной реакции,  ;
;
- сохраняются неизменными во времени активности (концентрации, парциальные давления) всех участников реакции в каждой точке реакционного пространства,  ;
;
- энергия Гиббса системы минимальна, а энтропия – максимальна, 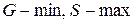 .
.
- изменения энергии Гиббса и энтропии равны нулю, 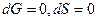 , при этом
, при этом 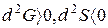 .
.


 G S
G S

 |  |
Состояние системы Состояние системы
Химическое равновесие характеризуется:
- динамичностью, т.е. в условиях равновесия реакции не прекращаются, а протекают как в прямом, так и в обратном направлении с одинаковыми скоростями;
- подвижностью, т.е. равновесие смещается в ту или иную сторону при изменении внешних условий и восстанавливается при возвращении условий к начальным;
- возможностью достижения равновесного состояния как «слева» со стороны исходных веществ, так и «справа» со стороны продуктов реакции, например, в равновесной смеси будут присутствовать йодид водорода, водород и йод, если в сосуд поместить только HI или только H2 и I2, то есть
2HI ↔ H2 + I2 или H2 + I2 ↔ 2HI.
Признаками химического равновесия являются неизменность состава реакционной смеси (необходимый) и подвижность системы (достаточный).
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 214; Нарушение авторских прав?; Мы поможем в написании вашей работы!