
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика реакций
|
|
|
|
Условия выполнения реакции
Аналитические реакции
Реакцию, используемую для аналитических целей, принято называть аналитической реакцией, а вещество, ее вызывающую – реагентом. В аналитике используют реакции, сопровождающиеся явными (или хорошо заметными) внешними эффектами. Это могут быть изменение цвета или интенсивности окраски раствора, образование или растворение осадка, выделение газа с определенным запахом или цветом и т.д.
Аналитический сигнал или аналитический признак – любое свойство системы отличающее ее от остальных.
В качественном анализе различают три вида реакций: реакции открытия (обнаружения) тех или иных веществ, групп, ионов и т.д.; реакции идентификации (подтверждения) или проверки правильности открытия; реакции осаждения (отделения), используемые в систематическом анализе для разделения групп ионов.
Аналитические реакции по способу их выполнения делятся на «мокрые», которые проводятся в (водных) растворах, и «сухие», к которым относят:
- окрашивание пламени газовой горелки солями (обычно летучими хлоридами, карбонатами, нитратами) некоторых металлов в определенный цвет, например, Na − желтый, K − фиолетовый, Sr − карминово-красный, Ba − зеленый, Ca − кирпично-красный;
- образование окрашенных перлов (стекол) при сплавлении, например, Na2B4O7·10H2O, NaNH4HPO4·4H2O с солями металлов: Cr − изумрудно-зеленые, Mn − аметистово-фиолетовые;
- метод растирания, образования окрашенных соединений на фарфоровой пластинке, например, синего (NH4)2[Co(SCN)4] при совместном растирании CoSO4 и NH4SCN.
В зависимости от массы анализируемого вещества различают макроанализ (>1 г), микроанализ (1 мг ÷ 1 мкг), ультрамикроанализ (<1 мкг). На практике чаще имеют дело с полумикроанализом, занимающим промежуточное положение.
Среда (кислая, нейтральная или щелочная) создается прибавлением к раствору кислоты, щелочи или буферного раствора; например, осадки, растворимые в кислотах, не образуются в кислой среде.
Температура должна быть соответствующей, так как осадки (например, PbCl2) могут растворяться в горячем растворе; некоторые реакции идут на холоде, некоторые – при нагревании.
Концентрация должна быть достаточной, так как осадок образуется только из пересыщенного раствора, то есть когда его концентрация больше растворимости.
Чувствительность реакции характеризуется взаимосвязанными показателями:
- открываемый минимум (m) – наименьшая масса вещества (в мкг), которая может быть обнаружена посредством данной реакции. Аналитическим целям удовлетворяют реакции, для которых m < 50 мкг;
- минимальная (предельная) концентрация (1: q) – характеризует минимальную концентрацию Cmin, при которой обнаружение вещества возможно в небольшом (одной капле) объеме раствора; q – объем раствора (мл), в котором содержится 1 грамм вещества;
- предельное разбавление (q) − величина, обратная концентрации; аналитическим целям удовлетворяют реакции, эффективные при разбавлении более 1000.
Если минимальный объем, требуемый для обнаружения ионов Vmin (мл), то
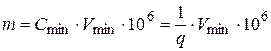 .
.
Аналитическая реакция тем чувствительнее, чем меньше открываемый минимум и предельная концентрация и чем больше предельное разбавление.
Специфичность. Специфической реакцией на данный ион называется такая реакция, которая позволяет обнаружить его в условиях опыта в смеси с другими ионами. Например, реакция со щелочью является специфической для обнаружения NH4+ в виде NH3 по запаху.
Ионные уравнения
При анализе неорганических веществ в большинстве случаев имеют дело с водными растворами кислот, оснований, солей, являющихся электролитами. Поэтому «мокрыми» реакциями открывают ионы, а не элементы или вещества.
Все реакции в (водных) растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций − ионными уравнениями.
В этих уравнениях в молекулярной форме записываются вещества, которые:
- мало ионизируют (НОН),
- малорастворимы (выпадают в осадок, BaSO4↓),
- являются газами (CO2↑),
- являются простыми веществами (О2).
Например:
1. NaOH + HCl → NaCl + HOH – уравнение в молекулярной форме;
Na+ + OH‾ + H+ + Cl‾ → Na+ + Cl‾ + HOH – уравнение в ионной форме, полное ионное уравнение;
OH ‾ + H+ → HOH – сокращенное ионное уравнение.
2. BaCl2 + K2SO4 → 2KCl + BaSO4↓;
Ba2+ + 2Cl‾ + 2K+ + SO42‾ → 2K+ + 2Cl‾ + BaSO4↓;
Ba2+ + SO42‾ → BaSO4↓ – сокращенное ионное уравнение.
Для обнаружения Cl‾ используют раствор AgNO3:
HCl + AgNO3 → AgCl↓ + HNO3
− образуется белый творожистый осадок. Данной реакцией открывают не элемент хлор вообще, а именно хлорид ион Cl‾. Она неэффективна, если хлор присутствует в ином виде, например, NaClO3 или CHCl3. Также можно отметить, что реагентом является не AgNO3, а именно Ag+, а суть реакции выражается сокращенным ионным уравнением:
Ag+ + Cl− → AgCl.
Глава1.Качественный дробный и систематический анализы
Применяя специфические реакции можно обнаружить соответствующие ионы так называемым дробным методом, то есть непосредственно в отдельных порциях («раздробленного») исследуемого раствора, не учитывая возможное присутствие других ионов. При этом не имеет значения и порядок открытия ионов.
Если нет специфических реакций, то используют определенную последовательность реакций обнаружения отдельных ионов, представляющую систематический ход анализа. Он состоит в том, что к обнаружению каждого данного иона приступают лишь после того, как все другие ионы, мешающие его обнаружению, будут предварительно обнаружены и удалены из раствора.
Например, анализируемая смесь предположительно содержит Ca2+ и Ba2+, а нужно определить, есть ли Ca2+. Оба катиона образуют белые осадки с оксалат анионом (наиболее чувствительная реакция на кальций). Поэтому сначала выясняют, есть ли в растворе Ba2+, действуя хроматом калия, зная, что хромат кальция растворим:
Ba2+ + CrO42− → BaCrO4↓.
Если в отдельной порции раствора присутствие Ba2+ не подтвердилось, то открывают в другой порции Ca2+. Если Ba2+ присутствует, то его отделяют осаждением в виде желтого BaCrO4 центрифугированием или фильтрованием, проверяя полноту осаждения добавлением к фильтрату капли реагента. Затем в фильтрате открывают Сa2+ добавлением (NH4)2C2O4. Образование белого осадка доказывает присутствие Ca2+.
Кроме осаждения для отделения используют выпаривание и экстракцию органическими растворителями.
При систематическом ходе анализа ионы выделяют из сложной смеси не по одиночке, а целыми группами, пользуясь одинаковым отношением их к действию некоторых реагентов, называемых групповыми реагентами. Выделяемые группы ионов называют аналитическими группами. Групповой реагент должен удовлетворять следующим требованиям:
- практически полное осаждение (10-6 М);
- осадок должен легко растворяться в кислотах;
- избыток реагента не должен мешать открытию оставшихся ионов.
Существуют различные системы анализа: сульфидная, кислотно-щелочная, фосфатная и т.д.
Систематический ход анализа смеси катионов I ÷ VI групп
Анализ смеси катионов I÷VI групп начинают с открытия дробным методом катионов: NH4+, Na+, Fe2+, Fe3+, Сr3+, Sn2+, Mn2+, Bi3+, Sb3+, Co2+, Ni2+, Cu2+:
NH4+ - нагреванием со щелочами,
Na+ - методом фотометрии пламени,
Fe2+ - в солянокислой среде реакцией с К3[Fe (CN)6],
Fe3+ - в солянокислой среде реакцией с К4[Fe (CN)6],
Cr3+ - реакцией окисления в кислой среде до Cr2O72− и пероксида хрома СrO5 + амиловый спирт,
Sn2+ - реакцией с фосфоромолибдатом аммония (NH4)3[PMo12 O40],
Mn2+ - реакцией окисления висмутатом в кислой среде до МnO4−,
Bi3+ и Sb3+ - гидролизом,
Со2+ - реакцией с роданидом аммония NH4SCN + амиловый спирт,
Ni2+ - реакцией с диметилглиоксимом в присутствии NH3+амиловый спирт,
Сu2+ - реакцией с К4[Fe (CN)6],
- реакцией с избытком концентрированного аммиака.
Таблица 1
Классификация катионов при кислотно-щелочной системе анализа
| № анали тической группы | Катионы | Групповой реагент | Аналитический сигнал | Примечание |
| I | Ag+, Pb2+, Hg22+ | 2N HCl | Образование белых осадков AgCl, PbCl2, Hg2Cl2 | хлориды не раств. в воде и разб. кислотах |
| II | Ca2+, Ba2+, Sr2+ | 2N H2SO4 | Образование белых осадков CaSO4, BaSO4, SrSO4 | сульфаты не раств. в воде и разб. кислотах |
| III | Al3+, Zn2+, Cr+3, Sn2+, Sn4+, As+3, As+5 | 4N NaOH (избыток) | Растворение сначала образовавшихся осадков в избытке реагента | амфотерные гидроксиды растворимы в избытке щелочи с образованием AlO2−, CrO2−, ZnO22−, AsO43−,.. |
| IV | Fe2+, Fe3+, Mn2+, Mg2+, Sb3+, Sb5+, Bi3+ | 25% р-р NH3 (избыток) | Образование осадков гидроксидов Fe(OH)2, Fe(OH)3, Mn(OH)2, … | гидроксиды не раств. в воде и избытке щелочи |
| V | Cu²+, Ni2+, Co2+, Cd2+ | 25% р-р NH3 (избыток) | Растворение сначала образовавшихся осадков в избытке реагента | гидроксиды не раств. в воде, но растворимы в растворе аммиака с образованием амминокомплексов [Cu(NH3)4]2+, [Ni(NH3)6]2+, … |
| VI | Na+, K+, NH4+ | — | — | хлориды, сульфаты, гидроксиды раств. в воде |
Отделение I группы катионов
К 20 каплям исследуемого раствора прибавляют этиловый спирт (10 капель), 30 капель НСl, раствор перемешивают, нагревают. После 5–минутного охлаждения осадок центрифугируют. В осадке присутствует I аналитическая группа, а в центрифуге – катионы II÷VI групп. Осадок промывают 2÷3 раза 0,1 N раствором HCl и приступают к открытию в нем Pb2+, Hg22+, Ag+. Промывные воды выбрасывают.
Отделение II группы катионов
Из центрифугата удаляют нагреванием спирт (полнота удаления определяется по отсутствию запаха спирта) и прибавляют к нему раствор 2 N H2SO4 до полноты осаждения. Раствор нагревают и центрифугируют. В осадке находятся сульфаты катионов II аналитической группы BaSO4, SrSO4, а в центрифугате катион Сa2+ и катионы III÷VI аналитических групп. К раствору добавляют спирт, нагревают и дают постоять 1÷2 минуты. При наличии в исследуемом растворе Сa2+ он выпадает в виде сульфата. Центрифугируют. В осадке CaSO4, а в центрифугате катионы III÷VI аналитических групп. Осадок промывают 0,1 N раствором Н2SO4 (промывные воды выбрасывают), обрабатывают при перемешивании в течение 1÷2 минут холодной водой и центрифугируют. В центрифугате обнаруживают кальций по реакции:
1) с хромом темно-синим в присутствии NH3∙H2O (pH ~ 9÷10),
2) с (NH4)2C2O4 + CH3COOH.
Раствор, содержащий смесь катионов III÷VI групп, кипятят до полного удаления спирта (по запаху), упаривают до небольшого объема (0,5÷1,0 мл), отбирают в пробирку 10 капель этого раствора и анализируют на присутствие катионов К+ и Na+.
Отделение катионов III группы от катионов IV ÷ VI групп
К раствору, содержащему смесь катионов III÷VI групп (20 каплям), прибавляют несколько капель (5÷6) пероксида водорода и концентрированный (6 N) раствор NaOH (10 капель) до полного осаждения.
Раствор нагревают в течение 3÷5 минут при тщательном перемешивании стеклянной палочкой. Избыток пероксида водорода удаляют кипячением. Все катионы III группы переходят в раствор в виде [Al(OH)4]−, [Zn(OH)4]2−, [Sn(OH)6]2−, CrO42−.
Катионы IV÷V групп остаются в осадке в виде соответствующих гидроксидов. Центрифугированием отделяют осадок от раствора. Центрифугат, содержащий третью аналитическую группу, исследуют на присутствие катионов этой группы.
Осадок промывают дистиллированной водой (промывные воды выбрасывают) и анализируют, как указано ниже.
Отделение катионов IV группы от катионов V группы
К осадку гидроксидов IV и V групп прибавляют при нагревании 3÷4 капли Н2О2 и затем 2 N НNО3 до полного растворения осадка (Н2О2 прибавляют для растворения осадка МnО(ОН)2). Раствор катионов IV÷V групп нейтрализуют по каплям 2 N раствором соды до появления слабой мути, добавляют к нему 2÷3-х кратный объем концентрированного аммиака и нагревают до 40÷50о С. При этом катионы V группы остаются в растворе в виде комплексных соединений, а IV группа катионов выпадает в осадок в виде гидроксидов. Осадок отделяют от раствора центрифугированием, промывают 2÷3 раза концентрированным аммиаком (промывные воды выбрасывают) и анализируют на присутствие катионов IV группы.
Раствор амминокомплексов катионов V группы разрушают 2 N раствором серной кислоты, доводя среду до слабокислой (проба индикаторной бумагой), и анализируют на присутствие катионов этой группы дробным методом.
Систематический ход анализа смеси катионов I÷VI групп приведен в таблице 2.
Дробный анализ катионов
Ниже в таблице 3 приведены реагенты (Р), аналитические реакции, методики эксперимента и аналитические сигналы для выполнения качественного анализа смеси катионов в растворе Задачи (З) дробным способом.
Дробный анализ анионов
Качественный анализ анионов выполняют дробным путем, поэтому их не делят на аналитические группы, а классификация, основанная на различной растворимости в воде солей бария и серебра соответствующих кислот, имеет целью упорядочение (табл.4).
Таблица 2
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 1224; Нарушение авторских прав?; Мы поможем в написании вашей работы!