
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексонометрия
|
|
|
|
Иодометрия
Основная реакция: I2 + 2ē ↔ 2I−. Йод – окислитель, йодид − восстановитель.
Индикатор (специфический) − 5% раствор крахмала.
Первичный стандартный раствор: Дихромат калия К2Cr2O7, 0,02н раствор.
Реакция: Cr2O72− + 6ē + 14 H+ ↔ 2Cr3+ + 7H2O.
 г/экв.
г/экв.
Вторичный стандартный раствор (титрант):
1. Тиосульфат натрия Na2S2O3·5H2O, 0,02н раствор.
Реакция: S4O62− + 2ē ↔ 2S2O32−, 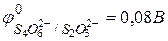 .
.
Этс = Мтс = 248,19 г/экв.
2. Йод I2, 0,02н раствор.
Рекция: I2 + 2ē ↔ 2I−,  .
.

Вспомогательный раствор: 10% KI; 2н Н2SO4.
Индикатор: 0,5% раствор крахмала.
Определяемые вещества:
1. Окислители. Определяют методом замещения, например, дихромат калия; nдх = n  = nтc.
= nтc.
К2Cr2O7 + 6KI + 7Н2SO4 → Сr2(SO4)3 + 3I2 + 4К2SO4 +7H2O
3I2 + 2Na2S2O3 → 2NaI + Na2S4O6.
2. Восстановители. Определяют обратным титрованием, например, сульфит натрия; nсн = n  – nтс.
– nтс.
Na2SО3 + I2 + H2O → 2HI + Na2SO4 (+ избыток I2)
I2 (избыток) + 2 Na2S2O3 → 2NaI + Na2S4O6.
Основная реакция: Na2H2EDТА + Ме2+ → Na2МеEDТА + 2Н+.
Первичные стандартные растворы:
Сульфат магния MgSO4, оксид магния MgO, оксид цинка ZnO, 0,01н растворы.
 .
.
Вторичный стандартный раствор: Двунатривая соль этилендиаминтетрауксусной кислоты (трилон Б, комплексон-III) Na2H2EDТА•2Н2О (или Na2H2ЭДТА•2Н2О), 0,05н раствор.
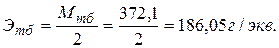
Структурная формула трилона Б:
 ,
,
Фиксирование ТЭ осуществляют индикаторным методом с применением металлоиндикаторов H2R. Это слабые органические кислоты, образующие неустойчивые окрашенные комплексы с катионами металлов, которые разрушаются в присутствии более сильных лигандов, входящих в комплексон. Титрование проводят в буферном слабощелочном растворе.
Mg2+ + H2R(синий) ↔ MgR(розовый) + 2H+
MgR(розовый) + Na2H2EDТА ↔ Na2MgEDTA + Н2R(синий)
Определяемые вещества:
1. Катионы, например, Са2+, Mg2+, Al3+, Fe3+, Tl4+ − прямым титрованием;  .
.
1. Анионы − обратным титрованием;  .
.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 201; Нарушение авторских прав?; Мы поможем в написании вашей работы!