
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Робота 4.2. Визначення масової частки цукру прискореним йодометричним методом
|
|
|
|
Маса наважки залежно від передбачуваної масової частки цукру
| Передбачувана | Маса наважки, г | Передбачувана масова частка цукру в перерахунку на суху речовину, % | Маса наважки, г | ||
| масова частка цукру в перерахунку на суху речовину, % | у мірній колбі місткістю 200 см3 | у мірній колбі місткістю 250 см3 | у мірній колбі місткістю 200 см3 | у мірній колбі місткістю 250 см3 | |
| Від 2 до 5 | Від 11 до 15 | ||||
| > 6 > 10 | 12,5 | > 16 > 20 |
У колбу доливають на 2/3 об'єму воду і залишають стояти 5 хв, часто збовтуючи. Після цього з колбу додають 10,0 см3 розчину сірчанокислого цинку з масовою часткою 15 % і 10,0 см3 розчину гідроксиду натрію з масовою часткою 4 % (або розчину гідроксиду калію з масовою часткою 5,6 %), перемішують, доводять водою до мітки, знову перемішують і залишають стояти 15 хв. Рідину, що утворилася, фільтрують крізь складчастий фільтр в суху колбу місткістю 200 см3 і проводять гідроліз сахарози.
Гідроліз сахарози. Отриманий фільтрат об'ємом 50,0 см3, переносять у мірну колбу місткістю 100 см3 додають донього 5,0 см3 розчину соляної кислоти з масовою часткою 20 %. Колбу занурюють до водяної бані і витримують 8 хв при температурі 90 ºС. Потім вміст колби швидко охолоджують та нейтралізують натрієм вуглекислим або натрієм вуглекислим кислим чи гідроксидом калієм з масовою часткою 10 % і з використанням індикатора метилового червоного до появи жовто-рожевого забарвлення. Вміст колби доводять до мітки дистильованою водою і ретельно перемішують.
Отриманий розчин використовують для аналізування в кількостях, передбачених у методі.
Метод полягає у визначанні кількості окисної міді до і після відновлення лужного розчину мідним окисом. Обчислення окисної міді проводять йодометрично.
Для встановлення титру розчину тіосульфату натрію в колбу з притертою пробкою або у звичайну місткістю 250 см3, що закривають годинним склом, з бюретки або піпеткою приливають 20,0 см3 розчину двохромовокислого калію з молярною концентрацією 0,1 моль/дм3, доливають водою приблизно до 100 см3, додають під час помішування 4,0 см3 концентрованої сірчаної кислоти і 4,0 см3 розчину калію йодистого з масовою часткою 30%. Колбу закривають пробкою або годинним склом і залишають у темному місці на 2-3 хв, потім титрують розчином тіосульфату натрію, весь час інтенсивні перемішуючи рідину, доки коричневий колір розчину не перейде у світло-жовтий, додають 1,0 см3 розчину розчинного крохмалю з масовою часткою 1% і продовжують титрування до зникнення синього забарвлення і переходу його в зеленувате.
Поправковий коефіцієнт К до 0,1 моль/дм3 розчину обчислюють за формулою:
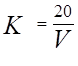 ,
,
де V – об'єм розчину тіосульфату натрію, витраченого на титрування, см3.
У конічну колбу місткістю 50 см3 відмірюють 3,0 см3 витяжки і 1,0 см3 розчину сірчанокислої міді масовою часткою 6,9 %.
Унаслідок того, що точні показники одержують у тому разі, коли різниця результатів титрування у контрольному і основному визначеннях перебуває в межах від 0,7 см3 до 1,2 см3 розчину тіосульфату натрію з молярною концентрацією 0,1 моль/дм3, витяжки з високою масовою часткою цукру беруть в об'ємі 1,0 см3 і додають 2,0 см3 дистильованої води або проводять попереднє додаткове розведення витяжки. Потім до зазначеного об'єму витяжки допивають 1,0 см3 лужного розчину калію-натрію виннокислого і кип'ятять на електроплитці 2 хв. з моменту закипання. Охолоджують до температури 23±4 °С на водяній бані зі спеціально сконструйованою кришкою, що дозволяє швидко занурювати колбочки в холодну воду і відводити їх у спеціальні гнізда.
Перерахування кількості 0,1 моль/дм3 тіосульфату натрію, що відповідає кількості відновленої мг), використовують коефіцієнти, встановлені експериментально:
- 3,3 – глюкоза;
- 3,7 – фруктоза;
- 3,4 – сахароза;
- 5,4 – мальтоза.
Масову частку цукру (Wц) в аналізованій пробі в перерахуванні на суху речовину обчислюють, за формулою:
 ,
,
Де V1 – V2 - різниця в кількості 0,1 моль/дм3 розчину тіосульфату натрію, витраченого на титрування, у контрольному досліді та визначенні;
K – коефіцієнт перерахунку на зазначений вид цукру;
m – маса речовини у взятій на визначення витяжці, мг;
W – вологість продукції, визначеної згідно з розділом 4, %;
100 – коефіцієнт перерахунку у відсотки.
Обчислювання проводять із точністю до 0,1 %.
Кінцевий результат беруть середньоарифметичне двох паралельних визначень.
Таблиця 4.1
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 314; Нарушение авторских прав?; Мы поможем в написании вашей работы!