
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительное декарбоксилирование пировиноградной кислоты (ПВК)
|
|
|
|
Аэробное окисление
Клетки, недостаточно снабжаемые кислородом, могут частично или полностью существовать за счет энергии гликолиза. Однако большинство животных и растительных клеток в норме находятся в аэробных условиях. В этих условиях пируват, образовавшийся при расщеплении глюкозы, не восстанавливается до лактата, а постепенно окисляется до СО2 и Н2О в аэробной стадии катаболизма, при этом первоначально происходит окислительное декарбоксилирование пировиноградной кислоты.
Окисление ПВК до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему, получившую название «пируватдегидрогеназный комплекс».
Процесс окислительного декарбоксилирования ПВК происходит в матриксе митохондрий. В нем принимают участие (в составе пируватдегидрогеназного комплекса) 3 фермента (пируватдегидрогеназа, дигидролипоилдегидрогеназа и дигидролипоилацетилтрансфераза) и 5 коферментов (тиаминпирофосфат (ТПФ (витамин В1)), амид липоевой кислоты, коэнзим А (СоА (витамин В3)), ФАД (флавинадениндинуклеотид (витамин В2)),НАД+(никотинамидадениндинуклеотид (витамин РР)).
Суммарную реакцию, катализируемую пируватдегидрогеназным комплексом, можно представить следующим образом:
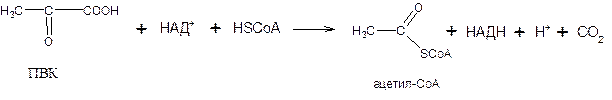
Образовавшийся в процессе окислительного декарбоксилирования ацетил-СоА окисляется далее в цикле трикарбоновых кислот с образованием СО2 и АТФ.
5.2.6.2 Цикл трикарбоновых кислот (Цикл Кребса).
Этот цикл известен также под названием цикла лимонной кислоты или цикла Кребса в честь Г. Кребса, определившего последовательность реакций цикла. За это открытие Кребс получил в 1953 году Нобелевскую премию.
Хотя цикл трикарбоновых кислот мы рассматриваем во взаимосвязи с катаболизмом углеводов, однако его роль в метаболизме веществ гораздо шире.
Цикл Кребса выполняет следующие функции:
1. Интегративную – объединяет пути катаболизма углеводов, жиров, белков; во всех аэробных организмах он выступает в роли центрального метаболического пути углерода.
2. Амфиболическую – выполняет не только катаболическую функцию распада ацетильных остатков, но и анаболическую, поскольку субстраты цикла используются для синтеза других веществ;
3. Энергетическую – совместно с цепью переноса электронов является основным поставщиком химической энергии в форме АТФ.
Реакции цикла протекают в матриксе митохондрий и представляют восемь последовательных превращений.
Первая реакция цикла начинается с конденсации ацетил-СоА с оксалоацетатом, в результате чего образуется лимонная кислота.
Реакция катализируется цитрат-синтазой (класс лиазы):

В результате второй реакции образовавшаяся лимонная кислота подвергается дегидрагированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную (изоцитрат). Обратимые реакции гидратации-дегидратации катализирует фермент аконитаза (класс лиазы):

Третья реакция лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД–зависимой дегидрогеназы (класс оксидоредуктазы):
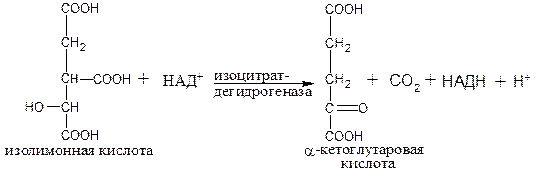
Во время четвертой реакции происходит окислительное декарбоксилирование a-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-СоА.
Механизм этой реакции сходен с механизмом реакции окислительного декарбоксилирования ПВК. a-кетоглутаратдегидроге-назный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс (см. пируватдегидрогеназный комплекс):

Пятая реакция катализируется ферментом сукцинил-СоА-синтетазой (класс лигазы):

Данная реакция является реакцией субстратного фосфорилирования, т.к. за счет высокоэргической тиоэфирной связи сукцинил-КоА происходит образование высокоэргической фосфатной связи ГТФ.
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой (класс оксидоредуктазы), простетической группой при этом является ФАД.

Седьмая реакция осуществляется под влиянием фермента фумаратгидратазы (класс лиазы):
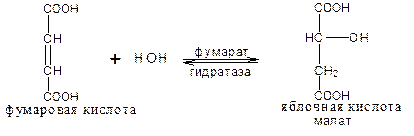
В ходе восьмой реакции цикла трикарбоновых кислот под влиянием НАД-зависимой малатдегидрогеназы происходит окисление яблочная кислоты в оксалоацетат:
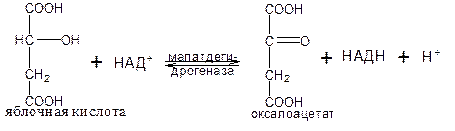
Таким образом за один оборот цикла происходит полное окисление одной молекулы ацетил-СоА и регенерация оксалоацетата, который вновь может конденсироваться с новой молекулой ацетил-СоА.
Схематически цикл Кребса представлен на рис. 2.
5.2.6.3 Дыхательная цепь переноса электронов. Окислительное фосфорилирование, биосинтез АТФ
Для непрерывной работы цикла Кребса необходимо постоянное поступление в систему ацетил-СоА, а восстановленные коферменты НАДН и ФАДН2 должны снова и снова окисляться. НАДН и ФАДН2 окисляются молекулярным кислородом не сразу и непрямо (в реакциях цикла Кребса молекулярный кислород нигде не участвует, хотя этот цикл является аэробным, т.е. кислородзависимым). Процесс идет постепенно с помощью последовательно функционирующих окислительно-восстановительных систем, переносящих водород, отнятый у субстрата в виде эквивалента электронов и протонов к молекулярному кислороду. Совокупность этих систем получила название дыхательной цепи переноса электронов.
Ферментные системы, составляющие дыхательную цепь переноса электронов, встроены во внутренней мембране митохондрий.

Митохондрии – это органеллы клетки (рис.3), играющие роль «силовых станций» клетки. Данная органелла является местом, где протекает цикл трикарбоновых кислот и окисление жирных кислот, генерирующие восстановленные коферменты, которые затем окисляются с помощью дыхательной электронтранспортной цепи.
 Рис. 2 Цикл Кребса
Рис. 2 Цикл Кребса
Митохондрия окружена двумя мембранами с сильно различающимися свойствами. Внутренняя мембрана митохондрии является барьером для протонов. Она способна пропускать такие молекулы как вода, молекулярный кислород, СО2, но фактически непроницаема для большинства полярных и ионизированных веществ (Na+, K+, НАД+, НАДН и т.д.). Наружная мембрана свободно проницаема для соединений с молекулярной массой около 10.000.
Компоненты дыхательной цепи распределены по плоскости внутренней мембраны равномерно. Они находятся в липидном окружении, прочно связаны с мембраной.
Также в митохондриальной мембране находится АТФ-синтетазный комплекс, ответственный за образованием АТФ.
Синтез АТФ из АДФ и фосфорной кислоты, который происходит с использованием энергии, освобождающейся при окислении веществ в живых клетках, и сопряжен с переносом электронов по дыхательной цепи, называется окислительным фосфорилированием.
Дыхательная цепь переноса электронов включает пять комплексов белков, в состав которых входят:
1. пиридинзависимые дегидрогеназы, коферментом которых является НАД+
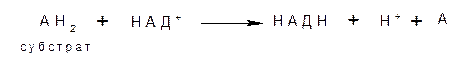
2. флавинзависимые дегидрогеназы, коферментом которых является ФАД или ФМН

3. небелковый переносчик убихинон, который называют коферментом
Q (KoQ).

4. Цитохромная система.
Цитохромы представляют собой гемопротеины, т.е. белки, содержащие в качестве простетической группы – гем. В составе гема имеется ион железа, который при переносе электронов подвергается обратимому окислению-восстановлению.

Цитохромы относятся к одноэлектронным окислительно-восстановительным соединениям. Они не могут принимать или отдавать водород, поэтому их называют переносчиками электронов.
Цитохромы подразделяются на цитохромы а, в, с и d в соответствии с положением их спектральных полос поглощения в восстановленном состоянии. Гемовые простетические группы цитохромов также имеют небольшие структурные различия; кроме того они отличаются структурой белка, с которым связан гем. Цитохромы а и а3 существуют и функционируют в виде единого прочного комплекса. Особенностью комплекса а×а3 является наличие в нем меди, связанной с компонентом а3, необходимой для его функционирования.
Перенос электронов комплексом а×а3 включает следующие реакции:

Особенностью комплекса а×а3 является то, что эта система цитохромов непосредственно реагирует с молекулярным кислородом воздуха, т.е. электроны передаются на кислород, переводя его в ионы. Комплекс а×а3 называют цитохромоксидазой.
5.Железосерные белки, или негеминовые белки, т.е. белки, в составе которых железо не связано с гемом.
Компоненты дыхательной цепи расположены по мере возрастания окислительно-восстановительного потенциала. Окислительно-восстанови-тельной потенциал пары НАД/НАДН + Н+ = -0,32 В, а пары О2/Н2О = +0,82 В.
Последовательность реакций, протекающих в дыхательной цепи переноса электронов представлена в виде схемы (рис. 4).

Процесс начинается с переноса электронов и протонов от восстановленного субстрата АН2 к НАД+ (например: малат + НАД+ ® оксалоацетат + НАДН + Н+ (см. реакции цикла Кребса)).
Восстановленный НАДН + Н+ передает два электрона и два протона ФМН. От флавина электроны и протоны переходят к убихинону (CoQ). После убихинона пути электронов и протонов расходятся. Электроны в определенной последовательности передаются по цепи цитохромов и, наконец, через цитохромоксидазу (а×а3) достигают кислорода воздуха, переводя его в ион. При этом осуществляется одноэлектронный перенос по системе цитохромов. Существует также укороченная дыхательная цепь, когда субстрат А1Н2 взаимодействует с ФАД-дегидрогеназой (например: янтарная кислота + ФАД ® фумаровая кислота + ФАДН2 (см. реакции цикла Кребса)), которая восстанавливается до ФАДН2 и далее электроны и протоны идут на CoQ. Дальнейший путь электронов и протонов совпадают.
Протоны после убихинона выталкиваются в межмембранное пространство митохондрии за счет энергии, извлекаемой при движении электронов по дыхательной цепи.
В результате наружная сторона внутренней мембраны заряжается положительно, а матрикс митохондрии – отрицательно. Возникает электрохимический градиент концентраций ионов ΔМН+.

Диффузия протонов обратно через мембрану, т.е. в область с их меньшей концентрацией, происходит по концентрационному градиенту и сопряжена с фосфорилированием, осуществляемым АТФ-синтетазой.
Согласно хемиосмотической теории, разработанной П. Митчелом, энергия, сосредоточенная в протонном потенциале, используется АТФ-синтетазой для выполнения химической работы, т.е. синтеза АТФ:
АДФ + Н3РО4 ® АТФ + НОН
В данном случае синтез АТФ происходит одновременно за счет энергии, выделяемой по мере продвижения электронов по дыхательной цепи, т.е. одновременно с окислением водорода, снятого с субстрата до воды, синтезируется АТФ. Такой способ синтеза АТФ называется окислительным фосфорилированием.
В дыхательной цепи в трех пунктах происходит сопряжение переноса электронов (окисления) и фосфорилирования. Первым этапом является перенос электронов от восстановленной анаэробной дегирогеназы НАДН + Н+ к флавиновой дегидрогеназе ФМН. Второй точкой сопряжения является переход электронов от цитохрома в на цитохром с1. Третья молекула АТФ выделяется, когда цитохромоксидаза (а×а3) передает электроны кислороду воздуха. Таким образом, при окислении молекулы водорода, снятой с субстрата НАД-зависимой дегидрогеназой, синтезируется 3 молекулы АТФ. Если водород передается ФАД-зависимой дегидрогеназой, то первая точка сопряжения минуется, поскольку от ФАДН2 электроны и протоны передаются коферменту Q, следовательно образуется только 2 молекулы АТФ.
5.2.6.4 Энергетика аэробного окисления глюкозы
Итак, полный путь окисления глюкозы включает гликолиз, окислительное декарбоксилирование ПВК, в результате чего образуется ацетил-СоА, окисление ацетил-СоА в цикле Кребса, передача водорода от НАДН + Н+ и ФАДН2 в виде эквивалента протонов и электронов по дыхательной цепи и окисление его до воды.
При этом образование АТФ происходит как за счет субстратного, так и за счет окислительного фосфорилирования. Поэтому для расчета энергетического выхода учтем, что в процессе гликолиза за счет субстратного фосфорилирования образуется 4 молекулы АТФ (реакции 7 и 10). Кроме того, в реакции 6 образуется 2НАДН + Н+, которые могут передавать электроны и протоны в дыхательную цепь, т.е. окисляться. Однако, сами молекулы внемитохондриального НАДН не способны проникать через мембрану внутрь митохондрий. Для передачи цитоплазматического НАДН в дыхательную цепь могут быть использованы так называемые челночные механизмы:
1. глицерол – фосфатный;
2. малат – аспартатный.
При использовании глицерол-фосфатного челночного механизма окисление 1 молекулы НАДН дает две молекулы АТФ, а при использовании малат-аспартатного челночного механизма – 3 АТФ.
Значит, 2НАДН + Н (цитоплазматически перенесенные в митохондрию, например, с помощью малат-аспартатного челночного механизма) при окислении в дыхательной цепи дадут 6 АТФ, итого гликолиз дает 10 молекул АТФ, из которых вычтем 2, затраченные на активирование в реакциях 1 и 3, т.е. остается 8 молекул АТФ.
Т.к. при распаде глюкозы образуется 2 молекулы ПВК. Следовательно, в результате окислительного декарбоксилирования образуется 2НАДН + Н+, что эквивалентно 6АТФ.
В цикл Кребса от одной молекулы глюкозы также вступает 2 молекулы ацетил-СоА, следовательно, количество образовавшихся НАДН и ФАДН2 удвоим.
Итак, в реакциях 3, 4, 8 образуется 6 НАДН2 = 6×3 = 18 АТФ. В реакции 5 образуется 2ГТФ = 2 АТФ (за счет субстратного фосфорилирования), в реакции 6 – 2ФАДН2=2×2 = 4 АТФ. Итого: 8 + 6 + 18 + 2 + 4 = 38 молекул АТФ.
При использовании глицерол-фосфатного челночного механизма цитоплазматический НАДН образуется 2 АТФ, следовательно, общий энергетический выход будет равен 36 молекул АТФ, а не 38.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 3402; Нарушение авторских прав?; Мы поможем в написании вашей работы!