
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Е) синтез нитрилов и изонитрилов
|
|
|
|
CH3-Cl
J
иодистый вторбутил фтористый этил
В зависимости от того, в каком гибридном состоянии находится углерод, связанный с галогеном, все известные моногалогенопроизводные углеводородов делят на три группы:
а ) СSp3 –Hal
К этой группе относятся моно-, ди- и полигалогенопроизводные алканов и циклоалканов, например:
хлорметан (хлористый метил)
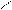 H2C - CH-Cl
H2C - CH-Cl
CH2
хлорциклопропан (хлористый циклопропил)
Для галогенопроизводных углеводородов характерны все типы изомерии, известные для ранее изученных классов соединений:
— по строению углеродного скелета,
— по положению галогена,
— геометрическая,
— пространственная,
— оптическая.
Реакционная способность галогенопроизводных углеводородов во многом определяется поляризуемостью и полярностью связи C—Hal.
Под поляризуемостью понимают способность внешних электронных оболочек атомов претерпевать деформацию под влиянием внешнего электромагнитного поля. В общем виде поляризуемость связи C—Hal изменяется следующим образом:
R-J > R-Br > R-Cl > R-F
Энергия связи С-Hal меняется в ряду:
D(C – F) > D(C – Cl) > D(C – Br) > D(C – J)
Моногалогенпроизводные имеют значительные дипольные моменты, что свидетельствует о полярности связи С-Hal. Это связано с более высокой электроотрицательностью атомов галогенов по сравнению с углеродными атомами:

Неподеленные пары электронов на атомах галогенов придают молекуле галогенуглеводородов слабые электронодонорные свойства, которые увеличиваются в ряду:
RJ > RBr > RCl > RF
Реакции нуклеофильного замещения – наиболее типичный круг реакций, в которых галогенуглеводороды выступают в качестве субстратов. Результатом этих реакций является замещение галогена на другой атом или группу, которые либо непосредственно выступают в роли нуклеофильного реагента, либо входят в его состав в качестве фрагмента.
Наиболее типичными реакциями нуклеофильного замещения галогеналканов и других галогенпроизводных являются:
а) реакции гидролиза
RHal + H2O ® ROH + HHal
RHal + NaOH ® ROH + NaHal
б) реакции образования простых эфиров (реакция Вильямсона)
RHal + R`ONa ® ROR` + NaHal
в) синтез сложных эфиров
R1Hal + RCOONa ® RCOOR1 + NaHal
г) аммонолиз
RHal + 2NH3 ® RNH2 + NH4Hal
д) синтез нитросоединений и нитритов


|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 354; Нарушение авторских прав?; Мы поможем в написании вашей работы!