
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения двухвалентного хрома
|
|
|
|
Соединения хрома
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl  CrCl2 + 2H2O
CrCl2 + 2H2O
Соединения хрома (II) - сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl  2CrCl3 + H2
2CrCl3 + H2 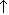
4Cr(OH)2 + O2 + 2H2O  4Cr(OH)3
4Cr(OH)3
Соединения трёхвалентного хрома Оксид хрома (III)Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
2Cr(OH)3  Cr2O3 + 3H2O
Cr2O3 + 3H2O
4K2Cr2O7  2Cr2O3 + 4K2CrO4 + 3O2
2Cr2O3 + 4K2CrO4 + 3O2 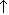
(NH4)2Cr2O7  Cr2O3 + N2
Cr2O3 + N2 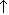 + 4H2O
+ 4H2O
Амфотерный оксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + 2NaOH  2NaCrO2 + H2O
2NaCrO2 + H2O
Cr2O3 + Na2CO3  2NaCrO2 + CO2
2NaCrO2 + CO2 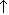
Cr2O3 + 6KHSO4  Cr2(SO4)3 + 3K2SO4 + 3H2O
Cr2(SO4)3 + 3K2SO4 + 3H2O
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
2Cr2O3 + 4KOH + KClO3  2K2Cr2O7(дихромат калия) + KCl + 2H2O
2K2Cr2O7(дихромат калия) + KCl + 2H2O
Гидроксид хрома (III) Cr(OH)3 - нерастворимое в воде вещество зелёного цвета.
Cr2(SO4)3 + 6NaOH  2Cr(OH)3
2Cr(OH)3  + 3Na2SO4
+ 3Na2SO4
Обладает амфотерными свойствами - растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3H2SO4  Cr2(SO4)3 + 6H2O
Cr2(SO4)3 + 6H2O
Cr(OH)3 + KOH  K[Cr(OH)4]
K[Cr(OH)4]
(или, упрощая, Cr(OH)3 + KOH  KCrO2(хромат калия) + 2H2O)
KCrO2(хромат калия) + 2H2O)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr+3Cl3  2Cr+2Cl2 + ZnCl2
2Cr+2Cl2 + ZnCl2
2Cr+3Cl3 + 16NaOH + 3Br2  6NaBr + 6NaCl + 8H2O + 2Na2Cr+6O4
6NaBr + 6NaCl + 8H2O + 2Na2Cr+6O4
Соединения шестивалентного хрома Оксид хрома (VI) CrO3 - ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и H2SO4(конц.).
K2CrO4 + H2SO4  CrO3 + K2SO4 + H2O
CrO3 + K2SO4 + H2O
K2Cr2O7 + H2SO4  2CrO3 + K2SO4 + H2O
2CrO3 + K2SO4 + H2O
CrO3 - кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH  K2CrO4 + H2O
K2CrO4 + H2O
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + H2SO4  K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + K2SO4 + H2O
В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH  2K2CrO4 + H2O
2K2CrO4 + H2O
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 453; Нарушение авторских прав?; Мы поможем в написании вашей работы!