
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидроксид железа (III)
|
|
|
|
Оксид железа (III)
Образуется при сжигании сульфидов железа, например, при обжиге пирита:
4FeS2 + 11O2  2Fe2O3 + 8SO2
2Fe2O3 + 8SO2 
или при прокаливании солей железа:
2FeSO4  Fe2O3 + SO2
Fe2O3 + SO2  + SO3
+ SO3 
Fe2O3 - основной оксид, в незначительной степени проявляющий амфотерные свойства
Fe2O3 + 6HCl  2FeCl3 + 3H2O
2FeCl3 + 3H2O
Fe2O3 + 2NaOH + 3H2O  2Na[Fe(OH)4]
2Na[Fe(OH)4]
Образуется при действии растворов щелочей на соли трёхвалентного железа: выпадает в виде красно–бурого осадка
Fe(NO3)3 + 3KOH  Fe(OH)3+ 3KNO3
Fe(OH)3+ 3KNO3
Fe(OH)3 – более слабое основание, чем гидроксид железа (II).
Это объясняется тем, что у Fe2+ меньше заряд иона и больше его радиус, чем у Fe3+, а поэтому, Fe2+ слабее удерживает гидроксид-ионы, т.е. Fe(OH)2 более легко диссоциирует.
В связи с этим соли железа (II) гидролизуются незначительно, а соли железа (III) - очень сильно. Гидролизом объясняется и цвет растворов солей Fe(III): несмотря на то, что ион Fe3+ почти бесцветен, содержащие его растворы окрашены в жёлто-бурый цвет, что объясняется присутствием гидроксоионов железа или молекул Fe(OH)3, которые образуются благодаря гидролизу:
Fe3+ + H2O 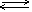 [Fe(OH)]2+ + H+
[Fe(OH)]2+ + H+
[Fe(OH)]2+ + H2O 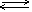 [Fe(OH)2]+ + H+
[Fe(OH)2]+ + H+
[Fe(OH)2]+ + H2O 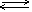 Fe(OH)3 + H+
Fe(OH)3 + H+
При нагревании окраска темнеет, а при прибавлении кислот становится более светлой вследствие подавления гидролиза. Fe(OH)3 обладает слабо выраженной амфотерностью: он растворяется в разбавленных кислотах и в концентрированных растворах щелочей:
Fe(OH)3 + 3HCl  FeCl3 + 3H2O
FeCl3 + 3H2O
Fe(OH)3 + NaOH  Na[Fe(OH)3]
Na[Fe(OH)3]
Соединения железа (III) - слабые окислители, реагируют с сильными восстановителями:
2FeCl3 + H2S  S + 2FeCl2 + 2HCl
S + 2FeCl2 + 2HCl
Качественные реакции на Fe3+
При действии гексацианоферрата (II) калия K4[Fe(CN)6] (жёлтой кровяной соли) на растворы солей трёхвалентного железа образуется синий осадок (берлинская лазурь):
4FeCl3 +3K4[Fe(CN)6]  Fe4[Fe(CN)6]3 + 12KCl
Fe4[Fe(CN)6]3 + 12KCl
При добавлении к раствору, содержащему ионы Fe3+ роданистого калия или аммония появляется интенсивная кроваво-красная окраска роданида железа(III):
FeCl3 + 3NH4CNS 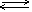 3NH4Cl + Fe(CNS)3
3NH4Cl + Fe(CNS)3
(при взаимодействии же с роданидами ионов Fe2+ раствор остаётся практически бесцветным).
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1832; Нарушение авторских прав?; Мы поможем в написании вашей работы!