
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Берилий Магний кальций. 3 страница
|
|
|
|
43. Алкадиены. Алкадиены (диены, диеновые углеводороды) – соединения, в молекулах которых присутствуют две двойные связи. Общая формула C n H 2n-2. Номенклатура диенов СН2 = СН – СН = СН2 бута диен -1,3 (дивинил). Кумулированные диены – соединения, в молекулах которых две двойные связи расположены у одного и того же атома углерода: СН2=С=СН–СН2–СН3 (пентадиен-1,2) Сопряженные диены – соединения, в молекулах которых две двойные связи разделены одной простой связью: СН2=СН–СН=СН–СН3 (пентадиен-1,3) Изолированные диены – соединения, в молекулах которых две двойные связи разделены более чем одной простой связью. СН2=СН–СН2–СН=СН2 (пентадиен-1,4). Все 4 атома С в sp2-гибридизации, 2 двойных связи. Происходит частичное перекрывание π -электронных облаков между 2-м и 3-м атомами углерода, и четыре р -орбитали образуют единое π -электронное облако. Такой тип перекрывания орбиталей называют сопряжением. Четыре электрона не локализованы попарно на двойных связях, а распределены вдоль всей цепи – делокализованы. 1. В промышленности бутадиен-1,3 и изопрен получают каталитическим дегидрированием бутана и 2-метилбутана, выделенных из фракций нефтеперегонки.. Бутадиен-1,3 в промышленности получают из этилового спирта по методу С.В.Лебедева. Лабораторный способ – реакции отщепления, например: СН2Br-СН2-СН2-СН2Br + 2КОН ® СН2=СН-СН=СН2 + 2KBr + 2H2O. В промышленности диены используют для получения синтетического каучука. Углеводороды, содержащие две и более двойные связи в молекуле – терпены – широко распространены в растительных организмах, часто обладают приятным запахом. Смеси терпенов используют в производстве духов и ароматических отдушек, а также в медицине. Важнейшие представители сопряженных диенов: СН2 = СН-СН = СН2 бутадиен 1,3 СН2 = С(СН3)-СН = СН2 изопрен. Химические свойства. 1) Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды. Особенностью присоединения к алкадиенам с сопрженными двойными связями является способность присоединять молекулы как в положении 1 и2 так и в положении 1 и4. а) присоединение водорода (гидрирование) СН2=СН-СН=СН2+Н2 → СН3-СН=СН-СН3 б) присоединение галогенов СН2=СН-СН=СН2 + Cl2→ СН2Cl-СН=СН-СН2Cl в) присоединение галогеноводородов СН2=СН-СН=СН2+HCl →СН3-СН=СН-СН2Cl 3. Полимеризация nСН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-)n (каучук)
44.Алкины. Алкины (ацетиленовые углеводороды) – углеводороды, молекулы которых содержат тройную связь углерод-углерод. Общая формула алкинов – CnH2n-2. Тройную связь обозначают суффиксом - ин. Главная цепь должна включать в себя тройные связи, а нумерация проводится так, чтобы они получили наименьшие номера. Атомы углерода тройной связи находятся в состоянии sp -гибридизации. Сигма-связи, образуемые sp-гибридными атомами углерода, расположены под углом 180о друг к другу. Тройная связь короче и прочнее двойной связи. Она образована тремя парами электронов и включает одну σ- и две π-связи. Две π-связи лежат во взаимно перпендикулярных плоскостях. 1. Изомерия скелета 2. Изомерия положения тройной связи. 3. Межклассовая изомерия. Алкинам изомерны, например, алкадиены и циклоалкены. Алкины не обладают геометрической изомерией. Гидрирование алкинов протекает в тех же условиях, что гидрирование алкенов. В зависимости от количества водорода может образоваться алкен или алкан. Алкины менее активны в электрофильном присоединении, чем алкены. Почему? Потому что тройная связь короче и прочнее, чем двойная. Поэтому в некоторых случаях для осуществления реакции необходимы специальные условия (например, присутствие солей ртути в качестве катализатора). 1. Галогенирование. Обесцвечивание бромной воды – качественная реакция на алкины, так же как на алкены.2) Гидрогалогенирование (присоединение галогеноводорода) Реакция присоединения галогеноводорода протекающая по электрофильному механизму, также идет в две стадии, причесм на обеих стадиях выполняется правило Марковникова: СН3-С№СН+HBr=> CH3-CBr=CH2 2-бромпропен CH3-CBr=CH2+HBr=>CH3-CBr2-CH3 2,2 дибромпропан. 3) Гидратация (присоединение воды): Большое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова СН№СН+Н2О=HgSO4,H2SO4= СН3-СН=О. Кислотные свойства алкинов Алкины, у которых при тройной связи есть атом водорода, проявляют свойства очень слабых кислот. Они реагируют, например, с водно-аммиачными растворами солей Cu(I) и Ag(I). Атом водорода замещается на атом металла, выпадает осадок соли, которая называется ацетиленидом. При горении смеси ацетилена с кислородом температура пламени достигает 2800–3000оС – можно плавить многие металлы. На этом свойстве основана ацетиленовая сварка. Кроме того, ацетилен используют в промышленном органическом синтезе для получения винилхлорида, акрилонитрила, винилацетилена – исходных веществ при производстве распространенных полимеров.
45. Арены. Родоначальник ароматических углеводородов – бензол – был выделен Майклом Фарадеем в 1825 года из конденсата светильного газа. Соединения, обладающие подобной структурой, стали называть ароматическими. На основе квантовомеханических расчетов Э. Хюккель сформулировал критерии ароматичности: 1. Молекула (или ее часть) должна быть циклической и плоской. 2. Она должна содержать сопряженные p-электроны. Это могут быть электроны двойных связей или неподеленных электронных пар атомов. 3. Число p-электронов должно быть равным 4n+2, где n = 0,1,2… (правило Хюккеля) Ароматическими являются все циклические сопряженные полиеновые системы, содержащие 4n+2, где n неотрицательное целое число, делокализованных π- электронов. Бензол подходит под это правило с n =1. Арены похожи на остальные углеводороды – они нерастворимы в воде и легче ее. Бензол при комнатной температуре – бесцветная прозрачная жидкость со своеобразным запахом. Тпл = 5,5оС, Ткип = 80оС. Бензол токсичен и легко воспламеняется. Номенклатура аренов Согласно номенклатуре ИЮПАК, арены с одним бензольным кольцом рассматривают как производные бензола. В качестве главной цепи выбирают бензольное кольцо. Многие арены имеют свои исторические названия. Нумерацию начинают с одного из заместителей так, чтобы сумма номеров заместителей была минимальна. Если соединение содержит два заместителя у бензольного кольца, то располагаться они могут тремя разными способами друг относительно друга. Часто вместо нумерации для 1,2-дизамещенных бензолов используют обозначение орто -, для 1,3-замещенных – мета -, а для 1,4-замещенных – пара -Бензол – это стабильная высокосимметричная молекула, обладающая избытком электронной плотности. Разорвать p-электронное облако в молекуле бензола сложно. Поэтому бензол вступает в химические реакции значительно менее активно по сравнению с непредельными соединениями. Наиболее характерными являются реакции электрофильного замещения. Например, галогенирование, нитрование, сульфирование и алкилирование. В реакции галогенирования ни фторирование, ни йодирование не используется, так как фтор слишком активен, а йод не активен, и реакция с ним не идет. 1) Галогенирование (бромирование и хлорирование) При реакции с бромом в присутствии катализатора, бромида железа (3) один из атомов водорода в бензольном кольце может замещаться на атом брома. 2) Нитрирование.Большое промышленное значение имеет реакция нитрования бензола и его гомологов. При взаимодействии ароматического углеводорода с азотной кислотой в присутствии серной происходит замещение атома водорода на нитогруппу NO2.3) Сульфирование Бензол и другие арены при нагревании реагируют с концентрированной серной кислотой или олеумом – раствором SO3 в серной кислоте. Бензол применяется как растворитель и сырье для получения многочисленных и очень важных ароматических соединений, кот используются для производства красителей (анилин), полимеров (Стирол), лекарственных препаратов. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С6Н5-СН3 - метилбензол или толуол, С6Н4(СН3)2 - диметилбензол или ксилол, С6Н5—С2Н5 - этилбензол и т.д.
46. Спирты первичные, вторичные, третичные. По характеру атома углерода, с которым связана гидроксильная группа, спирты делятся на: первичные, в молекулах кот гидроксильная группа связана с первичным атомом углерода, например СН3-СН2-СН2-ОН пропанол-1. Вторичные, в молекулах кот гидроксо группа связана со вторичным атомом углерода, например, СН3-СНОН-СН3. Третичные, в молекулах кот гидроксильная группа связана с третичным атомом углерода (короче крест вспомни мудак). При образовании названий спиртов к названию углеводорода, соответсвующего спирту, добавляют суффикс –ол. Цифрами после суффикса указывают положение гидроксильной группы в главнй цепи, а предфиксами ди три тетра их число. В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей. Начиная с третьего члена гомологического ряда у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2) а с четвертого изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия- спирты изомерны простым эфирам. Валентные углы в 109о и 110о указывают на sp3-гибридизацию атома углерода, две неподеленные пары электронов кислорода расположены на sp3-гибридных орбиталях. 1) реакция с щелочными металлами. Спирт и вода в реакциях с натрием отдают ион водорода, т.е. в данной реакции они проявляют кислотные свойства. Продукт реакции спирта с натрием – соль. Общее название солей спиртов – алкоголяты. Реакции спиртов со щелочными металлами довольно широко используются в лабораторной практике. Остатки щелочных металлов опасно уничтожать, вводя их в реакцию с водой, поскольку вода очень активно взаимодействует с ними. Поэтому чаще всего для этих целей используют этиловый спирт.2) Реакция с щелочами. Свойства спиртов, которые являются изомерными, во многом похожи, но в некоторых реакциях они ведут себя по-разному. Сравнивая относительную молекулярную массу спиртов (Mr) c относительными атомными массами углеводородов, можно заметить, что спирты имеют более высокую температуру кипения. Это объясняется наличием водородной связи между атомом H в группе ОН одной молекулы и атомом O в группе ОН другой молекулы. При растворении спирта в воде образуются водородные связи между молекулами спирта и воды. Этим объясняется уменьшение объёма раствора (он всегда будет меньше, чем сумма объёмов воды и спирта по отдельности). Наиболее ярким представителем химических соединений этого класса является этиловый спирт. Его химическая формула C2H5-OH. Концентрированный этиловый спирт (он же - винный спирт или этанол) получают из разбавленных его растворов путём перегонки; действует опьяняюще, а в больших доза - это сильный яд, который разрушает живые ткани печени и клетки мозга. При этом нужно отметить, что этиловый спирт полезен в качестве растворителя, консерванта, средства понижающего температуру замерзания какого-либо препарата. Ещё один не менее известный представитель этого класса - метиловый спирт (его ещё называют - древесный или метанол). В отличии от этанола метанол смертельно опасен даже в самых малых дозах! Сначала он вызывает слепоту, затем просто "убивает"! гидратация этилена либо спиртовое брожение
47. Классификация спиртов. Многоатомные спитры. Спирты — органические соединения, содержащие одну или более гидроксильных групп (гидроксил,OH), непосредственно связанных с насыщенным (находящимся в состоянии sp-гибридизации) атомом углерода. Спирты можно рассматривать как производные воды (H-O-H), в которых один атом водорода замещен на органическую функциональную группу: R-O-H. По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа -ОН), многоатомные (две и более групп -ОН). двухатомный спирт – этиленгликоль (этандиол) HO–СH2–CH2–OH трехатомный спирт – глицерин (пропантриол-1,2,3) HO–СH2–СН(ОН)–CH2–OH В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты первичные R–CH2–OH, вторичные R2CH–OH, третичные R3C–OH. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на предельные, или алканолы (например, СH3CH2–OH) непредельные, или алкенолы (CH2=CH–CH2–OH) ароматические (C6H5CH2–OH). Особенности строения многоатомных спиртов: 1) содержат в молекуле несколько гидроксильных групп, соединенных с углеводородным радикалом; 2) если в молекуле углеводорода заменены гидроксильными группами два атома водорода, то это двухатомный спирт; 3) простейшим представителем таких спиртов является этиленгликоль (этандиол-1,2): СН2(ОН) – СН2(ОН); 4) во всех многоатомных спиртах гидроксильные группы находятся при разных атомах углерода; 5) для получения спирта, в котором хотя бы две гидроксильные группы находились бы при одном атоме углерода, проводилось много опытов, но спирт получить не удалось: такое соединение оказывается неустойчивым. Физические свойства многоатомных спиртов: 1) важнейшие представители многоатомных спиртов – это этиленгликоль и глицерин; 2) это бесцветные сиропообразные жидкости сладковатого вкуса; 3) они хорошо растворимы в воде; 4) эти свойства присущи и другим многоатомным спиртам, например этиленгликоль ядовит. Химические свойства многоатомных спиртов. 1. Как вещества, которые содержат гидроксильные группы, многоатомные спирты имеют сходные свойства с одноатомными спиртами. 2. При действии галогеноводородных кислот на спирты происходит замещение гидроксильной группы:СН2ОН-СН2ОН + Н СI -> СН2ОН-СН2СI + Н2О.3. Многие спирты обладают и особыми свойствами: многоатомные спирты проявляют более кислые свойства, чем одноатомные и легко образуют алкоголяты не только с металлами, но и с гидроксидами тяжелых металлов. В отличие от одноатомных спиртов, многоатомные спирты реагируют с гидроксидом меди, давая комплексы синего цвета (качественная реакция на многоатомные спирты).
48. Простые эфиры. Простыми эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R–O–R', где R и R' – различные или одинаковые радикалы. Простые эфиры рассматриваются как производные спиртов. Названия этих соединений состоят из названий радикалов и слова эфир (название класса). Для симметричных эфиров ROR используется приставка ди перед названием радикала, а в названиях несимметричных эфиров ROR' радикалы указываются в алфавитном порядке. Например, CH3OCH3 – диметиловый эфир; C2H5OCH3 – метилэтиловый эфир.Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов. Эфиры несимметричного строения R–O–R' образуются при взаимодействии алкоголята и галогенуглеводорода (синтез Вильямсона). Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана: C2H5ONa + CH3Cl =C2H5OCH3 + NaCl. В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (CH3O–). Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О–Н. Простые эфиры – малоактивные соединения, они значительно менее реакционноспособны, чем спирты. Хорошо растворяют многие органические вещества и поэтому часто используются как растворители. Наиболее характерные реакции простых эфиров: разложение под действием концентрированных иодоводородной или бромоводородной кислот R–O–R' + HI =ROH + R'I образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами R2O + HCl =[R2OH]+Cl- К важнейшим простым эфирам относятся и гетероциклические кислородсодержащие соединения – этиленоксид (эпоксид) и диоксан. Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси крест-О-СН3+О2=крест-О-О-СН3 Образование оксониевых соединений: неподеленная пара электронов атома кислорода в эфире способна взаимодействовать с протоном сильной кислоты, образуя непрочное оксониевое соединение: Ацидолиз. Концентрированные кислоты: H2SO4, HJ или FeCl3 в уксусном ангидриде – расщепляют простые эфиры: CH3—CH2—O—CH2—CH3 + HJ → CH3—CH2—OH + J—CH2—CH3
Реакция Шорыгина. Металлический натрий при нагревании расщепляет простые эфиры: C2H5–O–C2H5 + 2Na → C2H5ONa + C2H5Na.. Следует заметить, что простые эфиры изомерны одноатомным спиртам. Например, один и тот же состав С2Н6О имеют диметиловый эфир СН3—О—СН3 и этиловый спирт СН3—СН2–ОН. А составу С4Н10О отвечают не только диэтиловый, метилпропиловый и метилизопропиловый эфиры, но и 4 бутиловых спирта состава С4Н9ОН.
49.Фенолы. Фенолы характеризуются более сильными кислотными свойствами, чем спирты, последние в водных растворах не образуют карбониевые ионы AIk – O–, что связано с меньшим поляризующим действием (электроакцепторными свойствами акильных радикалов по сравнению с ароматическими). Спирты и фенолы тем не менее легко образуют водородные связи, поэтому все спирты и фенолы имеют более высокие температуры кипения, чем соответствующие углеводороды. Гидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. Можно ожидать, что в зависимости от этого свойства веществ будут существенно отличаться друг от друга из-за взаимного влияния групп атомов. Органические соединения, содержащие ароматический радикал фенил С6Н5- непосредственно связанный с гидроксильной группой проявляют особые свойства отличные от свойств спиртов. Такие соединения называются фенолами. Так же как и спирты, фенолы классифицируют по атомности, т е по количеству гидроксильных групп.(одноатомные(гидроксобензол, орто-крезол), многоатомные(1,2-дигидроксибензол) Твердое бесцветное кристаллическое вещество Тплав=43 Ткип=181, с резким характерным запахом. Ядовит. Фенол при комнатной температуре незначительно растворяется в воде. Ароматическое кольцо состоит из шести атомов углерода, образующих правильный шестиугольник, вследствии sp3-гибридизации электронных орбиталей шести атомов углерода. Эти атомы связаны сигма-связями. Неучаствующие в образовании сигма-связей p-электроны каждого атома углерода перекрывающиеся по разные стороны плоскости сигма-связей образуют две чести единого шестиэлектронного пи-облака, охватывающего все бензольное кольцо. В молекуле бензола С6Н6 ароматическое ядро абсолютно симметрично единое электронное пи-облако равномерно охватывает кольцо углерода под и над плоскостью молекулы. Изомерия Возможны 2 типа изомерии: -изомерия положения заместителей в бензольном кольце;-изомерия боковой цепи (строения алкильного радикала и числа радикалов). Физические свойства Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления. Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком! Химические свойства 1. Реакции с участием гидроксильной группы Кислотные свойства Диссоциация в водных растворах с образованием фенолят-ионов и ионов водорода;Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов);Взаимодействие с активными металлами с образованием фенолятов (образующиеся в результате реакций 2 и 3) феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов, следовательно, фенол — ещё более слабая кислота, чем угольная).При взаимодействии фенолятов с галогенпроизводными образуются простые и сложные эфиры (реакция Фриделя — Крафтса). 2. Реакции с участием бензольного кольца Реакции замещения -Галогенирование (взаимодействие с галогенами)-Нитрование (взаимодействие с азотной кислотой)-Сульфирование (взаимодействие с серной кислотой) Реакции присоединения -Гидрирование (восстановление водородом до циклогексанола) Качественные реакции на фенолы В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа (III) с образованием комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления синильной кислоты Способы получения 1. Из каменноугольной смолы. Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем — кислотой.2. Сплавление аренсульфокислот со щелочью: C6H5-SO3Na + NaOH > C6H5-OH + Na2SO33. Взаимодействие галогенпроизводных ароматических УВ со щелочами: C6H5-Cl + NaOH > C6H5-OH + NaClили с водяным паром: C6H5-Cl + H2O > C6H5-OH + HCl Применение фенолов Фенолы применяют в производстве различных феноло-альдегидных смол, полиамидов, полиарилатов, полиариленсульфонов, эпоксидных смол, антиоксидантов, бактерицидов и пестицидов (например, нитрафен). Алкилфенолы используют в производстве ПАВ, стабилизаторов и присадок к топливам. Двухатомные фенолы и их производные входят в состав дубителей для кожи и меха, модификаторов и стабилизаторов резин и каучуков, применяются для обработки кино- и фотоматериалов. В медицине фенолы и их производные используют в качестве антимикробных (фенол, резорцин), противовоспалительных (салол, осарсол), спазмолитических (адреналин, папаверин), жаропонижающих (аспирин, салициловая кислота), слабительных (фенолфталеин), адренолитических (мезатон), вяжущих (таннины) и других лекарственных средств, а также витаминов E и P.
50.Альдегиды. Альдегиды - органические вещества, молекулы которых содержат карбонильную группу, связанную с атомом водорода и углеводородным радикалом. Общая формула альдегидов или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой. Алгоритм составления названий альдегидов Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, включающая атом углерода альдегидной группы.Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода альдегидной группы. Назовите соединение по алгоритму для углеводородов. В конце названия допишите суффикс -аль. Физические свойства: формальдегид - газ с удушливым запахом, растворим в воде (с молекулами воды водородные связи образуются, 40 %-ный водный раствор называется формалином с увеличением температуры растворимость уменьшается); ацетальдегид - бесцветная легкокипящая жидкость с фруктовым запахом, растворим в воде; ацетон - бесцветная жидкость с резким запахом, растворим в воде. Химические свойства альдегидов и кетонов в значительной степени обусловлены наличием в их молекулах сильно полярной карбонильной группы (связь поляризована в сторону атома кислорода). Чем больше частичный заряд на атоме углерода этой группы, тем выше активность соединения. Горение: 2CH3CHO + 5O2 =4CO2 + 4H2O 2CH3COCH3 + 9O2 =6CO2 + 6H2O Присоединение (по двойной связи карбонильной группы). В ряду HCHO 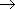 RCHO
RCHO 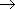 RCOR' склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы. а) Гидрирование (восстановление водородом): HCHO + H2 =t,Ni=CH3OH CH3—CO—CH3 + H2 =t,Ni=CH3—CH(OH)—CH3 Из альдегидов при этом получаются первичные спирты, а из кетонов - вторичные. Окисление: CH3CHO + Ag2O =Т=2Ag + CH3COOH (реакция "серебряного зеркала" - качественная реакция) HCHO + 2Cu(OH)2 =Т=2H2O + Cu2O + HCOOH (образуется красный осадок - качественная реакция) Замещение атомов водорода в углеводородном радикале (замещение происходит в
RCOR' склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы. а) Гидрирование (восстановление водородом): HCHO + H2 =t,Ni=CH3OH CH3—CO—CH3 + H2 =t,Ni=CH3—CH(OH)—CH3 Из альдегидов при этом получаются первичные спирты, а из кетонов - вторичные. Окисление: CH3CHO + Ag2O =Т=2Ag + CH3COOH (реакция "серебряного зеркала" - качественная реакция) HCHO + 2Cu(OH)2 =Т=2H2O + Cu2O + HCOOH (образуется красный осадок - качественная реакция) Замещение атомов водорода в углеводородном радикале (замещение происходит в  -положение, т. е. замещается атом водорода у 2-го атома углерода)/ Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три s- связи (одна из них – связь С–О), которые расположены в одной плоскости под углом 120° друг к другу. Связь С=О сильно полярна. Электроны кратной связи С=О, в особенности более подвижные π-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд. Альдегиды характеризуются высокой реакционной способностью. Большая часть их реакций обусловлена наличием карбонильной группы.
-положение, т. е. замещается атом водорода у 2-го атома углерода)/ Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три s- связи (одна из них – связь С–О), которые расположены в одной плоскости под углом 120° друг к другу. Связь С=О сильно полярна. Электроны кратной связи С=О, в особенности более подвижные π-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд. Альдегиды характеризуются высокой реакционной способностью. Большая часть их реакций обусловлена наличием карбонильной группы.
51. Кетоны. Кетонами называются карбонилсодержащие соединения, в которых углерод карбонильной группы связан с двумя углеродными радикалами. R-CO-R. В соответствии с международной номенклатурой названия кетонов строятся из названия соответствующего углеводорода с добавлением окончания – он. В конце названия ставится цифра, указывающая положение в цепи атома углерода, с которым связан карбонильный кислород. Если разветвленность одинакова, то нумеруют с того конца цепи, к которому ближе расположена карбонильная группа. Для некоторых кетонов распространены тривиальные названия, например ацетон. Физические свойства. Простейшие кетоны являются бесцветными жидкостями, которые растворяются в воде. Кетоны обладают приятным запахом. Высшие кетоны – твердые вещества. Газообразных кетонов не бывает, так как уже простейший из них (ацетон) – жидкость. Многие химические свойства, характерные для альдегидов, проявляюся и у кетонов. 2) гидрирование кетонов в присутствии катализаторов приводит к образованию вторичных спиртов. Кетоны окисляются значительно труднее альдегидов и только сильными окислителями. При окислении кетонов происходит разрыв (деструкция) углеродной цепи, и образуется смесь продуктов. Кетоны не вступают в реакцию «серебряного зеркала».  Получение: 1) кетоны образуются при окислении или каталитическом дегидрировании вторичных спиртов в присутствии медных катализаторов 2) как и альдегиды, кетоны можно получить гидролизом дигалогенпроизводных алканов. Чтобы получился кетон, оба атома галогена в исходном соединении должны находиться при одном (не крайнем) атоме углерода: 3) кетоны образуются в результате присоединения воды к гомологам ацетилена в присутствии катализаторов – солей ртути (II). Ацето́н (диметилкето́н, 2-пропано́н) — органическое вещество, имеющее формулу CH3—C(O)—CH3, простейший представитель насыщенных кетонов. Ацетон — бесцветная подвижная летучая жидкость (при н.у.) с характерным резким запахом. Во всех соотношениях смешивается с водой, диэтиловым эфиром, бензолом, метанолом, этанолом, многими сложными эфирами и так далее. Ацетон хорошо растворяет многие органические вещества, в частности, ацетил- и нитроцеллюлозы, воски, алкалоиды и так далее, а также ряд солей.
Получение: 1) кетоны образуются при окислении или каталитическом дегидрировании вторичных спиртов в присутствии медных катализаторов 2) как и альдегиды, кетоны можно получить гидролизом дигалогенпроизводных алканов. Чтобы получился кетон, оба атома галогена в исходном соединении должны находиться при одном (не крайнем) атоме углерода: 3) кетоны образуются в результате присоединения воды к гомологам ацетилена в присутствии катализаторов – солей ртути (II). Ацето́н (диметилкето́н, 2-пропано́н) — органическое вещество, имеющее формулу CH3—C(O)—CH3, простейший представитель насыщенных кетонов. Ацетон — бесцветная подвижная летучая жидкость (при н.у.) с характерным резким запахом. Во всех соотношениях смешивается с водой, диэтиловым эфиром, бензолом, метанолом, этанолом, многими сложными эфирами и так далее. Ацетон хорошо растворяет многие органические вещества, в частности, ацетил- и нитроцеллюлозы, воски, алкалоиды и так далее, а также ряд солей.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 447; Нарушение авторских прав?; Мы поможем в написании вашей работы!