
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. 1. В лабораторных условиях оксид серы (IV) получают из солей сернистой кислоты действием на них сильными кислотами: +2H2O+2H2O 2HSO-3+2H+=2SO2+H2O
|
|
|
|
Получение
1. В лабораторных условиях оксид серы (IV) получают из солей сернистой кислоты действием на них сильными кислотами:
+2H2O+2H2O 2HSO-3+2H+=2SO2+H2O 2NaHSO3+H2SO4=Na2SO4+2SO2Na2SO3+H2SO4=Na2SO4+S02
2. Также сернистый газ образуется при взаимодействии концентрированной серной кислоты при нагревании с малоактивными металлами:
+2Н2ОCu+2H2SO4=CuSO4+SO2
+2H2OCu+4Н++2SO2-4=Cu2++ SO2-4+SO2
3. Оксид серы (IV) образуется также при сжигании серы в воздухе или кислороде:
S+О2=SO2
4. В промышленных условиях SO2 получают при обжиге пирита FeS2 или сернистых руд цветных металлов (цинковой обманки ZnS, свинцового блеска PbS и др.):
4FeS2+11О2=2Fe2O3+8SO2
Структурная формула молекулы SO2:

В образовании связей в молекуле SO2 принимают участие четыре электрона серы и четыре электрона от двух атомов кислорода. Взаимное отталкивание связывающих электронных пар и не-поделенной электронной пары серы придает молекуле угловую форму.
1. Оксид серы (IV) проявляет все свойства кислотных оксидов:
— взаимодействие с водой,
— взаимодействие с щелочами,
— взаимодействие с основными оксидами.
2. Для оксида серы (IV) характерны восстановительные свойства:
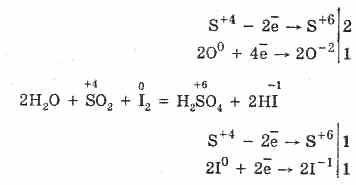
2S+6O-23 (в присутствии катализатора, при нагревании)«S+4O2+O02
Но в присутствии сильных восстановителей SO2 ведет себя как окислитель:

Окислительно-восстановительная двойственность оксида серы (IV) объясняется тем, что сера имеет в нем степень окисления +4, и поэтому она может, отдавая 2 электрона, окисляться до S+6, а принимая 4 электрона, восстанавливаться до S°. Проявление этих или других свойств зависит от природы реагирующего компонента.
Оксид серы (IV) хорошо растворим в воде (в 1 объеме при 20°С растворяется 40 объемов SO2). При этом образуется существующая только в водном растворе сернистая кислота:
H2SO3«SO2+Н2О
Реакция обратимая. В водном растворе оксид серы (IV) и сернистая кислота находятся в химическом равновесии, которое можно смещать. При связывании H2SO3 (нейтрализация кислоты) реакция протекает в сторону образования сернистой кислоты; при удалении SO2 (продувание через раствор азота или нагревание) реакция протекает в сторону исходных веществ. В растворе сернистой кислоты всегда имеется оксид серы (IV), который придает ему резкий запах.
Сернистая кислота обладает всеми свойствами кислот. В растворе диссоциирует ступенчато:
Н++SO2-3«Н++HSO-3 HSO-3«H2SO3
Термически неустойчива, летуча. Сернистая кислота, как двухосновная, образует два типа солей:
— средние — сульфиты (Na2SO3);
— кислые — гидросульфиты (NaHSO3).
Сульфиты образуются при полной нейтрализации кислоты щелочью:
H2SO3+2NaOH=Na2SO3+2Н2О
Гидросульфиты получаются при недостатке щелочи:
H2SO3+NaOH=NaHSO3+Н2О
Сернистая кислота и ее соли обладают как окислительными, так и восстановительными свойствами, что определяется природой партнера по реакции.
1. Так, под действием кислорода сульфиты окисляются до сульфатов:
2Na2S+4O3+О02=2Na2S+6O-24
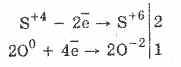
Еще легче протекает окисление сернистой кислоты бромом и перманганатом калия:
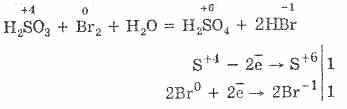
5H2S+4O3+2KMn+7O4=2H2S+6O4+2Mn+2S+6O4+K2S+6O4+3Н2O
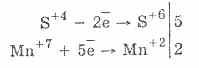
2. В присутствии же более энергичных восстановителей сульфиты проявляют окислительные свойства:
Из солей сернистой кислоты растворяются почти все гидросульфиты и сульфиты щелочных металлов.
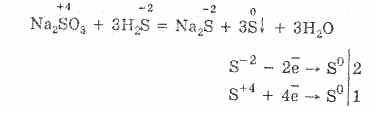
3. Поскольку H2SO3 является слабой кислотой, при действии кислот на сульфиты и гидросульфиты происходит выделение SO2. Этот метод обычно используют при получении SO2 в лабораторных условиях:
+H2ONaHSO3+H2SO4=Na2SO4+SO2
4. Растворимые в воде сульфиты легко подвергаются гидролизу, вследствие чего в растворе увеличивается концентрация OH--ионов:
NaHSO3+NaOH«Na2SO3+НОН
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 845; Нарушение авторских прав?; Мы поможем в написании вашей работы!