
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Галогены
|
|
|
|
Общая характеристика элементов 7 группы главной подгруппы. Галогены, свойства, применение, получение. Изменение окислительно-востановительных свойств.

В подгруппу галогенов входят фтор, хлор, бром, иод и астат. Первые четыре элемента встречаются в природе в виде различных соединений. Астат получен только искусственным путем, радиоактивен. Это р-элементы VII группы периодической системы Д. И. Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5 (см. табл. 14).
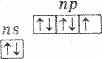
Этим объясняется общность их свойств. Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами. Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления: +1, +3, +5, +7. Возможные значения степеней окисления объясняются электронным строением атомов, которое у атома фтора можно представить схемой:
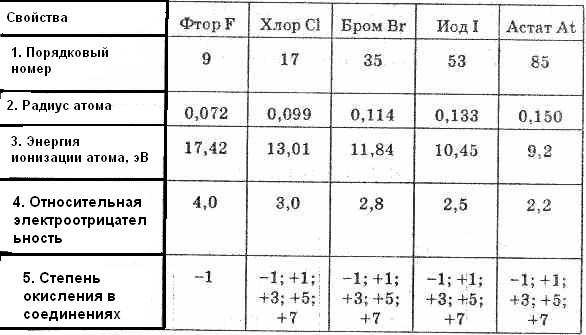
Таблица 14. Свойства элементов подгруппы галогенов
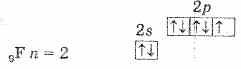
Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р-уровень. У него один неспаренный электрон, поэтому фтор бывает только одновалентным, а его степень окисления всегда -1.
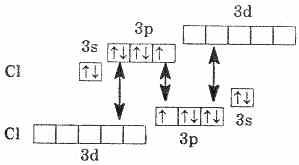
Электронное строение атома хлора выражается схемой:
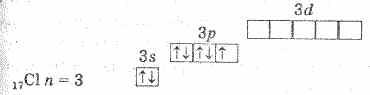
У атома хлора один неспаренный электрон на 3р-подуровне, и в обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде, то у него имеются еще пять орбиталей 3d-подуровня, в которых могут разместиться 10 электронов.
В возбужденном состоянии атома электроны хлора переходят с3p- и3s-подуровней на 3d-подуровень (на схеме показано стрелками). Разъединение (распаривание) электронов, находящихся на одной орбитали, увеличивает валентность на две единицы. Очевидно, что хлор и его аналоги (кроме фтора) могут проявлять лишь нечетную переменную валентность 1,3,5,7 и соответствующие положительные степени окисления. У фтора нет свободных орбиталей, а значит, при химических реакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрении свойств галогенов всегда надо учитывать особенности фтора.
В пределах каждого периода галогены являются наиболее электроотрицательными элементами, обладающими наибольшим сродством к электрону.
Внутри подгруппы галогенов переход от фтора к иоду сопровождается увеличением радиуса атома.
Элементы Подгруппы относятся к неметаллам; с увеличением заряда ядра от F к At неметаллические признаки ослабевают, o чем свидетельствуют уменьшение потенциалов ионизации и сродство к электрону.
Окислительно-восстановительные свойства и различия в химическом поведении галогенов легко понять, сравнивая эти свойства в зависимости от изменения заряда ядра при переходе от F к I. В ряду F, Cl, Br, I наибольшим радиусом атома (и, следовательно, наименьшим сродством к электрону) обладает I, поэтому он характеризуется менее выраженными окислительными свойствами, чем Br, Cl, F. Следовательно, окислительные свойства нейтральных атомов в подгруппе галогенов уменьшаются от F к I, а восстановительные усиливаются:

Связь Гал-Гал в молекулах простых веществ ковалентная неполярная. Длина связи в молекуле от F2 к I2 закономерно увеличивается. Энергия же связи изменяется следующим образом.
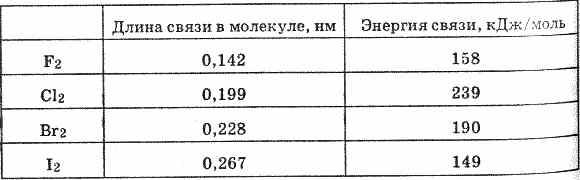
Энергия связи в молекуле F2 менее прочная, чем в молекуле Сl2. Это объясняется образованием в молекуле Сl2 и соответственно Br2 и I2 даттивной связи: когда общее энергетическое облако образуется за счет не только спаривания р-электронов, но и за счет уже имеющихся спаренных р-электронов одного атома и вакантной d-орбитали другого атома.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 3684; Нарушение авторских прав?; Мы поможем в написании вашей работы!