
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства галогенов
|
|
|
|
Фтор может быть только окислителем, что легко объяснить его положением в периодической системе химических элементов Д. И. Менделеева. Это сильнейший окислитель, окисляющий даже некоторые благородные газы:
2F2+Хе=XeF4
Высокую химическую активность фтора следует объяснить
о на разрушение молекулы фтора требуется намного меньше энергии, чем ее выделяется при образовании новых связей.
Так, вследствие малого радиуса атома фтора неподеленные электронные пары в молекуле фтора взаимно сталкиваются и ослабевает связь F—F.
Галогены взаимодействуют почти со всеми простыми веществами.
1. Наиболее энергично протекает реакция с металлами. При нагревании фтор взаимодействует со всеми металлами (в том числе с золотом и платиной); на холоду реагирует с щелочными металлами, свинцом, железом. С медью, никелем реакция на холоду не протекает, поскольку на поверхности металла образуется защитный слой фторида, предохраняющий металл от дальнейшего окисления.
Хлор энергично реагирует с щелочными металлами, а с медью, железом и оловом реакция протекает при нагревании. Аналогично ведут себя бром и иод.
Взаимодействие галогенов с металлами является экзотермическим процессом и может быть выражена уравнением:
2М+nHaI2=2МНаI H<0
Галогениды металлов являются типичными солями.
Галогены в этой реакции проявляют сильные окислительные свойства. При этом атомы металла отдают электроны, а атомы галогена принимают, например:

2. При обычных условиях фтор реагирует с водородом в темноте со взрывом. Взаимодействие хлора с водородом протекает на ярком солнечном свету.
Бром и водород взаимодействуют только при нагревании, а иод с водородом реагирует при сильном нагревании (до 350°С), но этот процесс обратимый.
H2+F2=2HF
Н2+Сl2=2НСl Н2+Br2=2НBr
350°2HI«Н2+I2
Галоген в данной реакции является окислителем.
Как показали исследования, реакция взаимодействия водорода с хлором на свету имеет следующий механизм.
Молекула Сl2 поглощает квант света hv и распадается на неорганические радикалы Сl.. Это служит началом реакции (первоначальное возбуждение реакции). Затем она продолжается сама собой. Радикал хлора Сl. реагирует с молекулой водорода. При этом образуется радикал водорода Н. и НСl. В свою очередь радикал водорода Н. реагирует с молекулой Сl2, образуя НСl и Сl. и т.д.
Сl2 +hv=Сl. +Сl.
Сl. +Н2=НСl+Н.
Н.+Сl2=НСl+С1.
и т.д.
Первоначальное возбуждение вызвало цепь последовательных реакций. Такие реакции называются цепными. В итоге получается хлороводород.
3. Галогены с кислородом и азотом непосредственно не взаимодействуют.
4. Хорошо реагируют галогены с другими неметаллами, например:
2Р+3Сl2=2РСl3 2Р+5Сl2=2РСl5 Si+2F2=SiF4
Галогены (кроме фтора) не реагируют с инертными газами. Химическая активность брома и иода по отношению к неметаллам выражена слабее, чем у фтора и хлора.
Во всех приведенных реакциях галогены проявляют окислительные свойства.
Взаимодействие галогенов со сложными веществами. 5. С водой.
Фтор реагирует с водой со взрывом с образованием атомарного кислорода:
H2O+F2=2HF+O
Остальные галогены реагируют с водой по следующей схеме:
НГал-1+НГал+1О«Гал02+Н2О
Эта реакция является реакцией диспропорционирования, когда галоген является одновременно и восстановителем, и окислителем, например:
Сl2+Н2OНСl+НСlO
Cl2+H2OH++Cl-+HClO
Сl°+1e-Сl-Cl°-1e-Сl+
где НСl — сильная соляная кислоты; НСlO — слабая хлорноватистая кислота
6. Галогены способны отнимать водород от других веществ, скипидар+С12 = НС1+углерод
Хлор замещает водород в предельных углеводородах: СН4+Сl2=СН3Сl+НСl
|
|
|
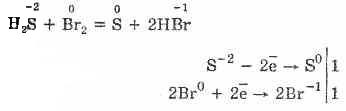
и присоединяется к непредельным соединениям:
С2Н4+Сl2=С2Н4Сl2
7. Реакционная способность галогенов снижается в ряду F—Сl — Br — I. Поэтому предыдущий элемент вытесняет последующий из кислот типа НГ (Г — галоген) и их солей. В этом случае активность убывает: F2>Сl2>Br2>I2

|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 982; Нарушение авторских прав?; Мы поможем в написании вашей работы!