
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Манганат и перманганат калия
|
|
|
|
Оксид марганца(VI). Марганцовистая кислота. Манганаты. Получение. Окислительно-восстановительные свойства манганатов.
Марганцеватая кислота. Реакция диспропорционирования.Соли марганцеватой кислоты (манганаты). Получение и свойства.
Оксид марганца(VI) — неорганическое соединение, окисел металла марганца с формулой MnO3, тёмно-красное аморфное вещество, реагирует с водой.
Образуется при конденсации фиолетовых паров, выделяемых при нагревании раствора перманганата калия в серной кислоте:
4KMnO4+2H2SO4---->4MnO3+2K2SO4+O2+2H2O
- Разлагается при нагревании:
2MnO3---->(50град)2MnO2+O2
- Реагирует с водой:
3MnO3+H2O----->2HMnO4+MnO2
- С щелочами образует соли — манганаты:
MnO3+2NaOH--->Na2MnO4
МАНГАНАТЫ, соли несуществующих в своб. состоянии к-т Mn.
соли марганцовой кислоты HMnO4 - перманганаты, фиолетово-черные кристаллы, а также марганцоватой H2MnO4 и марганцоватистой H3MnO4 к-т - зеленые кристаллы. Растворяются в воде. Окислители.
Манганат калия может проявлять свойства как окислителей, что более характерно (реакция 1), так и восстановителей (реакция 2):

2KI(-1)+K2Mn(+6)O4+2H2O=Mn(+4)O2+J2(0)+4KOH
2I- - 2e--->J2(0) |1
Mn(+6)+2e--->Mn(+4) |1
2K2Mn(+6)O4+Cl2(0)=2KMn(+7)O4+2KCl(-1)
Mn(+6)-e--->Mn(+7) |1
Cl2(0)+2e--->2Cl(-1) |1
Из соединений марганца (VI) наиболее характерны марганцоватая кислота Н2MnO4 и ее соли манганаты. И кислота, и ее соли малоустойчивы. Например, зеленый раствор манганата калия постепенно становится фиолетовым вследствие превращения его в перманганат; одновременно выпадает гидрат двуокиси марганца:
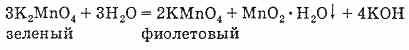
Вследствие перемены окраски раствора манганат калия в XVIII веке назвали минеральным хамелеоном (анион MnO2-4 придает раствору темно-зеленую окраску).
Манганат калия может проявлять свойства как окислителей, что более характерно (реакция 1), так и восстановителей (реакция 2):

Из соединений семивалентного марганца первым рассматривают оксид марганца (VII) Mn2O7, известный под названием марганцевого ангидрида. Это зеленая маслянистая жидкость. В свободном состоянии его можно получить действием на перманганат калия концентрированной серной кислоты:
2KMnO4+H2SO4=K2SO4+Mn2O7+Н2О
При обычной температуре и в неподвижном состоянии это соединение сравнительно устойчиво, а при встряхивании или при нагревании выше 55°С разлагается с сильным взрывом:
2Mn2O7=4MnO2+3O2
При взаимодействии с водой образует сильную марганцовую кислоту:
Mn2О7+Н2O=2НMnO4
Mn2O7 — один из сильнейших окислителей. Горючие вещества при малейшем контакте с Mn2O7 воспламеняются: 2Mn2O7+С2Н5ОН=4MnO2+2СO2+3Н2О
Марганцовая кислота НMnO4 известна только в растворе, она довольно сильная кислота. Анион MnO-4 придает раствору малиново-фиолетовый цвет. Так же как и Mn2O7, марганцовая кислота обладает ярко выраженными окислительными свойствами.
Соли марганцовой кислоты носят название перманганатов. Наиболее важным среди них является перманганат калия KMnO4.
Перманганат калия — кристаллическое вещество, растворимое в воде, его раствор имеет фиолетовый цвет, в быту называется «марганцовкой». Он широко применяется в аналитических определениях и в лабораторной практике. В промышленности KMnO4 используется для отбеливания некоторых волокон, для обработки древесины, для промывания газов, а также в медицине как дезин-фицирующее средство. Как и все соединения марганца (VII), является сильным окислителем. В зависимости от среды раствора (кислая, нейтральная или щелочная) Mn+7 восстанавливается до разных степеней окисления. В кислой среде продуктом восстановления перманганата являются соли марганца (II) Mn2+, в нейтральной среде, как правило, получается двуокись марганца MnО2, а в щелочной — соли марганцоватой кислоты Н2MnO4:
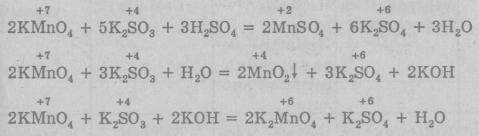
При нагревании перманганаты разлагаются с выделением кислорода и поэтому иногда применяются в лабораториях для его получения:
2KMnO4=K2MnO4+MnO2+O2
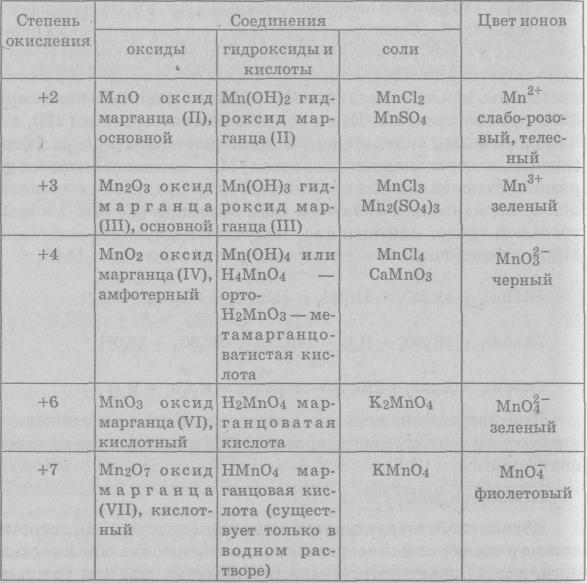
Изучая свойства соединений марганца (см. табл. 32), которые весьма разнообразны в зависимости от степени окисления последнего, можно заметить, что многие типичные для них реакции являются окислительно-восстановительными. Их поведение в окислительно-восстановительных реакциях подчиняется определенным правилам. Следует помнить, что:
1) Mn° и Mn+2 в окислительно-восстановительных реакциях ведут себя как восстановители;
2) Mn+7, наоборот, проявляет только окислительные свойства. Это нетрудно объяснить: Mn+7 полностью лишен валентных электронов и может только принимать их;
3) находясь в промежуточных степенях окисления, марганец может вести себя по-разному, т.е. проявлять как окислительные, так и восстановительные свойства в зависимости от того, с каким веществом он реагирует;
4) конечные продукты превращений марганца зависят от среды, I; в которой происходит реакция.
Влияние изменения степени окисления марганца на свойства его соединений
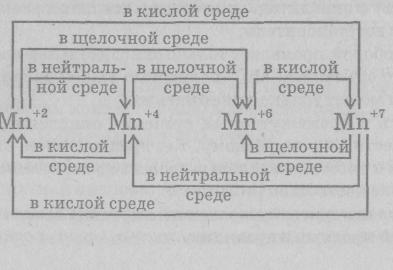
При определении продуктов, образующихся при окислении и восстановлении разных соединений, можно пользоваться схемой, в которой указаны степени окисления марганца:
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 19282; Нарушение авторских прав?; Мы поможем в написании вашей работы!