
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Марганец химические свойства
|
|
|
|
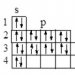
| Описание: Рассмотрим химические свойства марганца. В таблице Д.И. Менделеева элемент Mn находится в четвертом периоде, VII B группе. Его порядковый номер 25. Заряд ядра атома равен +25. Графическая электронная формула выглядит следующим образом (см. рисунок) Марганец принадлежит к семейству d-элементов, поэтому в образовании связей могут принимать участие не только 2 s-электроны, но и неспаренные электроны, расположенные на 3d-подуровне предвнешнего слоя. Будучи металлом, Mn в соединениях с неметаллами проявляет только положительную степень окисления. За счет электронов внешнего слоя его степень окисления может быть равна +2. Но если в образовании связей принимают участие и 3d-электроны предвнешнего слоя, то Mn в соединениях проявляет степень окисления +3, +4, +5 (малохарактерна), +6 или +7 (в зависимости от числа отданных 3d-электронов). Марганец при нагревании энергично взаимодействует с галогенами, образуя соли соответствующих кислородных кислот: Mn + Cl2 =MnCl2 Mn + F2 = MnF2 Реагирует с растворами кислот: Mn + 2HCl = MnCl2 + H2 Mn + H2SO4 разб. = MnSO4 + H2 Концентрированные H2SO4 и HNO3 окисляют марганец только при нагревании: Mn + 2H2SO4 -- MnSO4 + SO2 + 2H2O Mn + 4HNO3 -- Mn(NO3)2 + 2NO2 + 2H2O При сжигании в кислороде получается смешанный оксид Mn3О4 (MnО ∙ Mn2О3) 3Mn + 2О2 -- Mn3О4 С увеличением степени окисления Mn кислотные свойства этих оксидов и соответствующих им гидроксидов возрастают, а оснóвные уменьшаются. Марганец(II)-оксид является оснóвным, Mn2О3 и MnО2 обладают амфотерными свойствами, а Mn2О7 принадлежит к кислотным оксидам. Ему соответствует марганцовая кислота НMnО4. Она образуется при растворении Mn2О7 в H2O: Mn2О7 + H2O = 2HMnO4 В безводном состоянии марганцовая кислота не получена и может существовать только в разбавленных водных растворах (вплоть до w (НMnО4) = 20%). Это сильная кислота, в водном растворе она полностью распадается на ионы. Соли этой кислоты называются перманганатами. Известна еще марганцовистая кислота Н2MnО4. Но ни она, ни соответствующий ей кислотный оксид MnО3 в чистом виде выделить не удается. Получены лишь некоторые соли этой кислоты, которые называются манганатами (K2MnО4). Соединения марганца, в которых он проявляет степень окисления +4 и выше, обладают окислительными свойствами. Особенно сильно они выражены для тех веществ, в которых марганец проявляет свою высшую степень окисления +7. Наиболее известным таким соединением марганца (имеющим практическое значение) является KMnО4, соль марганцовой кислоты – калий-перманганат. Сильнее всего окислительные свойства KMnО4 проявляются в кислой среде, при этом марганец понижает свою степень окисления до +2. 5K2SO3 + 2KMnO4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3H2O Если аналогичную реакцию проводить в нейтральной среде, то марганец восстанавливается до +4 с образованием MnО2: 3K2SO3 + 2KMnO4 + H2O = 3K2SO4 + 2MnO2 + 2KOН В сильно-щелочной среде марганец восстанавливается до +6, при этом образуется соль марганцовистой кислоты K2MnО4: K2SO3 + 2KMnO4 + 2KOH = K2SO4 + 2K2MnO4 + H2O Следует подчеркнуть, что калий-манганат в растворе со временем распадается вследствие протекания реакции гидролиза: 3K2MnO4 + 2H2O = MnO2 + 2KMnO4 + 4KOH В сильнощелочной среде гидролиз K2MnО4 и ее последующий распад значительно замедляется. |
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 800; Нарушение авторских прав?; Мы поможем в написании вашей работы!