
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов. Сильные и слабые электролиты. Константа и степень диссоциации. Гидролиз солей. Буферные растворы. Произведение растворимости
|
|
|
|
Из альдегидов (кетонов), циангидринной синтез
Из a - галогензамещенных карбоновых кислот
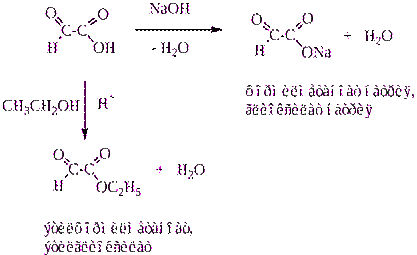
Методы получения оксикислот
ОКСИ(ГИДРОКСИ) КИСЛОТЫ
ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Реакции по карбонильной и карбоксильной группам
Реакционная способность
Оксокислоты более сильные кислоты, чем карбоновые (влияние акцепторной карбонильной группы), реакции идут по двум функциональным группам.
a -Оксокислоты

Общая формула:
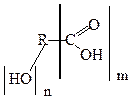
Оксикислоты – это органические кислоты (одно, двух, трехосновные), содержащие одну или несколько ОН – групп. Нумерация в молекулах оксикислот идет от старшей карбоксильной группы. Младшая – гидроксильная группа указывается в префиксе как окси(гидрокси)-группа.
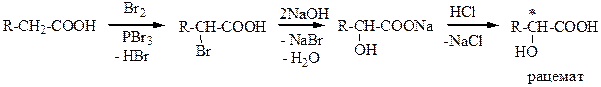

a-Оксикислоты являются более сильными кислотами, чем обычные карбоновые кислоты, что обусловлено наличием акцепторной (-ОН) группы в углеводородном радикале. Реакции оксикислот идут по одной или двум функциональным группам (-ОН, -СООН) в зависимости от природы реагента.



Билет №24
Химикам уже давно известно явление изомерии — когда два вещества имеют одну и ту же брутто-формулу (отражающую только количество разных атомов в веществе), но разные свойства — из-за разного порядка соединения атомов.
Особенно богата изомерами органическая химия. К примеру, этиловый спирт и диметиловый эфир имеют одну и ту же брутто-формулу: C2H6O, но структурная формула спирта — CH3–CH2–OH, а эфира — CH3–O–CH3. Эти вещества имеют разные свойства — как химические, так и физические (температура плавления, вязкость и т. д.).
В органической химии известны и так называемые оптические изомеры — молекулы, имеющие одинаковую структурную формулу, но не совместимые со своим зеркальным отражением. Простейший пример такой молекулы — это атом углерода с четырьмя разными заместителями. К примеру, СHClBrF или аланин CH3CHNH2COOH (рис. 1). Наличие у такой молекулы двух разных конфигураций связано с тем, что у атома углерода, образующего четыре одинарные связи, эти связи направлены к вершинам тетраэдра.
 Рис. 1. Аминокислота аланин CH3CHNH2COOH. Две молекулы, состоящие из атома углерода с четырьмя разными заместителями, — оптические изомеры. Живые существа используют только левовращающие изомеры аминокислот (на рисунке справа)
Рис. 1. Аминокислота аланин CH3CHNH2COOH. Две молекулы, состоящие из атома углерода с четырьмя разными заместителями, — оптические изомеры. Живые существа используют только левовращающие изомеры аминокислот (на рисунке справа)
|
Оптические изомеры имеют одинаковый цвет, температуру кипения, плотность. Однако такие вещества обладают интересным физическим свойством — они вращают плоскость поляризации пропущенного через них поляризованного света. Один изомер будет вращать ее влево, другой — вправо.
Атом углерода с четырьмя разными заместителями называется хиральным атомом (от греческого heiros «ладонь» — тот же корень, что и в слове «хиромантия»). Чем больше хиральных атомов в молекуле, тем больше у вещества может быть оптических изомеров.
Интересно, что возможны органические вещества, которые имеют оптические изомеры, хотя в них формально нет ни одного хирального атома — центра изомерии.
Билет №25
Степень диссоциации определяется константой диссоциации и концентрацией слабого электролита в растворе.

Данное выражение было впервые выведено немецким физикохимиком В. Оствальдом (закон разбавления Оствальда). Закон разбавления показывает, что степень диссоциации данного слабого электролита зависит от его концентрации и константы диссоциации.
Последняя в данном растворителе и для данного электролита зависит только от температуры.
При очень низкой степени диссоциации (α < 1%) принимают, что (1 − α) ≅ 1. Тогда уравнение Оствальда упрощается до формулы: K д = α2 с 0. В таком приближенном виде уравнение Оствальда чаще всего и используется химиками.
Рассматривая зависимость степени диссоциации от концентрации слабого электролита (рис. 6), мы обнаруживаем, что повышение концентрации ведет к снижению степени диссоциации, а разбавление раствора, наоборот, к ее повышению.
Вода. Автоионизация воды.
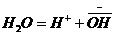
Константа автоионизации:
Кдисс» 10-16
С(Н2О)» 55 моль/л
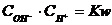

Для чистой воды 
Чем выше концентрация Н+, тем меньше концентрация ОН-. Концентрация молекул Н2О больше, чем концентрация Н+ в 55×107 раз.

В нейтральном растворе рН = 7;
в кислом растворе рН < 7;
в щелочном растворе рН > 7.
Диссоциация – это самопроизвольный процесс распада веществ на ионы под действием полярных молекул воды.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 757; Нарушение авторских прав?; Мы поможем в написании вашей работы!