
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
I часть
|
|
|
|
Типография КГЭУ
420066, Казань, Красносельская, 51
I Модуль
Тема 1. Основные термодинамические понятия.
Термодинамика идеального газа.
Программа. Термодинамическая система и окружающая среда. Изолированная и неизолированная ТДС. Параметры состояния. Уравнение состояния. Газовая постоянная. Термодинамическая поверхность. Тер-модинамический процесс. Равновесные и неравновесные процессы (взаи-модействия). Обратимые и необратимые процессы, p-v - диаграмма и термодинамические процессы в ней. Основные законы идеальных газов. Отличие идеального газа от реального. Теплота и работа как формы передачи энергии. Понятие о газовой смеси. Смеси идеальных газов. Закон Дальтона. Способы задания смеси. Парциальный объем компонента. Определение средней молекулярной массы смеси и ее газовой постоянной. Связь между массовыми и объемными долями. Определение парциальных давлений компонентов смеси.
Методические указания. Материалы этой темы, по существу, представляют собой необходимый комплекс определений и понятий, на базе которых излагаются последующие темы. Поэтому студент должен уделить особое внимание четкому усвоению этих понятий и определений. Надо ясно себе представить условность и необходимость деления рабочих тел на газы и пары, ясно представлять содержание нормальных условий и их назначение. Нужно уметь переходить от технической системы единиц к системе СИ и наоборот, знать размерности основных параметров. Необходимо знать физический смысл газовой постоянной и универсальной газовой постоянной, при каких условиях справедливо уравнение состояния идеального газа.
П Модуль
Тема 2. Теплоемкость идеальных газов и их смесей.
Программа. Молекулярно-кинетическая теория теплоемкости. Истинная и средняя теплоемкости. Эмпирические формулы теплоемкости газов. Свойства теплоемкостей идеального газа. Связь между изохорной и изобарной теплоемкостями идеального газа (закон Майера). Таблицы значений истинной и средней теплоемкостей газа. Теплоемкость смеси идеальных газов.
Методические указания. Из определения теплоемкости непосредственно следует, что она является функцией процесса. В приближенных расчетах процессов идеальных газов, теплоемкость может считаться величиной постоянной. Значения мольных изохорной и изобарной теплоемкостей зависят от атомности газов. В более точных расчетах необходимо учитывать зависимость теплоемкости идеального газа от температуры. Эта зависимость может быть представлена в виде таблиц или с по-
мощью интерполяционных полиномов различной степени, простейшими из которых являются выражения вида: с = а + bt;
cm = a1 + b1(t1 + t2), где с и сm - истинная и средняя теплоемкости соответственно.
Тема3. Первый закон термодинамики.
Программа. Историческое развитие открытия первого закона термодинамики. Первый закон ТД как закон сохранения и превращения энергии. Теплота и работа - формы передачи энергии. Принцип эквивалентности. Работа расширения. Внутренняя энергия. Аналитическое выражение первого закона термодинамики через внутреннюю энергию. Работа перемещения. Техническая работа. Энтальпия. Аналитическое выражение первого закона термодинамики через энтальпию. Формулировки первого закона термодинамики.
Методические указания. Ясно представлять себе различие двух форм передачи энергии - механической и тепловой. Знать различие между вну-тренней энергией идеального и реального газов, физический смысл внутренней энергии и энтальпии рабочего тела, физический смысл и отличие работы расширения, проталкивания и технической. Надо представлять, что I-й закон термодинамики является частным случаем фундаментального закона сохранения и превращения энергии и что устанавливаемые термодинамикой уравнения состояния и, в особенности, процессов изменения состояния справедливы только для равновесных термодинамических систем.
Ш Модуль
Тема 4. Основные термодинамические процессы идеальных газов.
Программа. Термодинамические процессы идеальных газов: изохорный, изотермический, адиабатный и политропный. Аналитическое ис-
следование их и графическое изображение в p-v и T-s диаграммах.
Методические указания. Надо ясно себе представлять методику анализа термодинамических процессов. Уметь правильно представлять любой процесс в p-v и T-s диаграммах, изменение внутренней энергии, ра-
боты и тепла в этом процессе. Следует иметь представление об обобща-ющем значении политропного процесса и уметь получать из общих вы-
ражений, относящихся к политропному процессу, частные, относящиеся к изобарному, изохорному, изотермическому и адиабатному процессам.
Тема 5. Второй закон термодинамики.
Программа. Круговые термодинамические процессы или циклы. Прямые или обратные циклы. Обратимые и необратимые циклы. Оценка эффективности прямого и обратного циклов. Прямой обратимый цикл Карно и его термический КПД. Обратимый цикл Карно и его холодильный коэффициент. Теорема Карно. Энтропия как функция состояния. Сущность второго закона термодинамики и его основные формулировки. Аналитическое выражение второго закона термодинамики. Изменение энтропии и работоспособность изолированной термодинамической сис-темы при обратимых и необратимых процессах. Термодинамические цик-лы в диаграммах. Термодинамическая шкала температур. Абсолютный нуль температуры. Эксергия как мера работоспособности. Эксергетичес-кий метод анализа работы тепловых машин.
Методические указания. Необходимо знать различие между обратимыми и необратимыми процессами, представлять формы проявления необратимости. Ясно представлять, что второй закон термодинамики устанавливает необходимые и достаточные условия, при которых возможно превращение теплоты в работу в периодически действующих тепловых машинах. Знать различные формулировки второго закона термодинамики и их общность. При этом надо учитывать, что естественные процессы не могут идти самостоятельно (без каких- либо изменений в окружающих телах в прямом и обратном направлениях). Чем отличается обратимый цикл от необратимого, прямой от обратного? Чем оценивается эффективность прямого и обратного циклов? Почему невозможен “вечный двигатель второго рода”; который, действуя непрерывно, превращал бы работу некоторого источника целиком в механическую работу? Каковы роль и значение цикла Карно в термодинамике? Зависит ли термический КПД цикла Карно от свойств рабочего тела? - все эти вопросы должны быть глубоко проработаны. Необходимо осмыслить энтропию как термодинамический параметр, ее физический смысл и значение. Как связано изменение энтропии с необратимостью процесса?
Тема 6. Дифференциальные уравнения состояния.
Равновесие термодинамических систем.
Программа. Характеристические функции. Внутренняя энергия, энтальпия, свободная энергия (изохорно-изотермический потенциал) и свободная энтальпия (изобарно-изо-термический потенциал). Дифференциальные состояния термодинамики. Термические коэффициенты и связь между ними. Зависимость изобарной и изохорной теплоемкостей от объема и давления. Связь между изобарной и изохорной теплоемкостями для веществ с любыми свойствами. Условия термодинамического равновесия. Фазовые переходы, правило фаз Гиббса. Фазовые диаграммы.
Методические указания. Характеристические функции и дифференциальные уравнения составляют основу математического аппарата термодинамики, поэтому усвоение материала этого раздела является особенно важным. В том случае, когда система обменивается с окружающей средой теплотой и механической работой (тепломеханическая система), имеются четыре характеристические функции: внутренняя энергия u, энтальпия i, свободная энергия (изохорно-изотермический потенциал) f и свободная энтальпия (изобарно-изотермический потенциал) 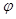 . Характеристической называется такая функция состояния, частная производная которой по определенным образом выбранному параметру равна параметру с ним сопряженному. Сопряженными параметрами являются T и s, p и v. Необходимо уметь практически использовать дифференциальные уравнения термодинамики для нахождения различных термодинамичес-ких величин и для решения термодинамических задач.
. Характеристической называется такая функция состояния, частная производная которой по определенным образом выбранному параметру равна параметру с ним сопряженному. Сопряженными параметрами являются T и s, p и v. Необходимо уметь практически использовать дифференциальные уравнения термодинамики для нахождения различных термодинамичес-ких величин и для решения термодинамических задач.
Термодинамические потенциалы используются для исследования ус-ловий равновесия и его устойчивости. Следует обратить внимание на особенности связи между различными термодинамическими величинами, которые позволяют вывести теоретическое уравнение состояния вещества, исследовать фазовые переходы. Необходимо уметь различать фазовые диаграммы p-T, T-s, p-v для стабильных состояний различных рабочих тел.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 355; Нарушение авторских прав?; Мы поможем в написании вашей работы!