
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
П часть 1 страница
|
|
|
|
IV Модуль
Тема 7. Реальные газы и пары. Водяной пар.
Программа. Термодинамические свойства реальных веществ. Диаграмма p-v при фазовых переходах жидкости и газа. Уравнение Ван-дер-Ваальса. Критические параметры веществ. Условия равновесия при фазовом переходе. Парообразование и конденсация. Зависимость давления насыщенного пара от температуры. Теплота фазового перехода. Степень сухости. Плавление. Сублимация. Фазовые диаграммы воды. Тройная точка. Аномалии воды. Удельный объем, энтальпия и энтропия жидкости, влажного, сухого и перегретого пара. Сверхкритическая область состояния пара. Таблицы термодинамических свойств воды и водяного пара. Диаграммы p-v, T-s, i-s для паров. Расчет процессов изменения состояния водяного пара по таблицам и диаграммам.
Методические указания. Нужно знать, что из-за сложности уравнения состояния водяного пара все расчеты производятся либо по таблицам (аналитический метод расчета), либо по диаграммам (графический метод). Необходимо ясно себе представлять устройство и пользование таблицами воды и водяного пара; знать, как на основании табличных данных строятся диаграммы T-s, i-s паров, уметь разъяснять ход различных линий в диаграммах, уметь изображать процесс получения перегретого пара из воды в различных диаграммах. Необходимо ясно представлять себе различие в свойствах газов и паров. Под этим же углом зрения оценивать термодинамические процессы. В связи с этим необходимо уметь объяснить, почему состояние насыщенного пара задается давлением (температурой) и степенью сухости пара, а не давлением и температурой, как газа, почему теплоемкость пара зависит от давления; почему в изотермическом процессе водяного пара изменение внутренней энергии не равна нулю, а в том же процессе для идеального газа равно нулю.
Нужно обратить внимание на то, что калорические величины водяного пара отсчитывают от условного нуля. Принято считать равной нулю энтальпию кипящей жидкости в тройной точке (P0 = 0,00611 бар и
t0 = 0,01 С). При этом энтропия кипящей жидкости в тройной точке так-же будет равна нулю. С достаточной для практических целей точностью, можно считать, что энтальпия и энтропия кипящей жидкости при темпе
ратуре, равной 0 С, и соответствующем давлении насыщения равны 0. Поэтому в T-s диаграмме пара нижняя пограничная кривая начинается
от температуры 273,15 0С, а в i-s диаграмме выходит из начала координат (i0 = 0 и s0 = 0).
Тема 8. Влажный воздух.
Программа. Абсолютная и относительная влажность. Температура точки росы. Влагосодержание. Диаграмма i-d влажного воздуха. Процессы сушки в диаграмме i-d.
Методические указания. Необходимо различать насыщенный и ненасыщенный влажный воздух. Чем отличается абсолютная влажность воздуха от его влагосодержания? Почему влажный воздух можно считать идеальным газом? Что такое температура точки росы и как она определяется? Что такое температура мокрого термометра и каков ее физичес-кий смысл? Необходимо уметь сопоставлять газовые постоянные, плотности и энтальпии влажного и сухого воздуха. Уметь объяснять структуру и пользование i-d диаграммой влажного воздуха. Почему в диаграмме процесс нагрева воздуха идет при d = const, а испарения - при i = const?
V Модуль
Тема 9. Термодинамика потока. Истечение. Дросселирование.
Программа. Уравнение неразрывности потока. Определение количества тепла для потока. Уравнение первого закона термодинамики для потока. Располагаемая работа. Адиабатные течения. Параметры полного адиабатного торможения потока. Сопло и диффузор. Скорость истечения и расход газа (пара) из сужающегося сопла. Максимальный расход и критическая скорость истечения. Критическое отношение давлений. Скорость звука. Зависимость скорости и расхода от отношения давлений. Ус-ловия перехода скорости потока через скорость звука. Комбинированное сопло Ловаля. Расчет скорости истечения водяного пара по изменению энтальпии. Течение с трением. Смешение потоков газа.
Дросселирование. Уравнение процесса. Техническое применение процесса дросселирования. Дросселирование идеального газа. Дросселирование водяного пара в диаграммах T-s, i-s. Потеря эксергии потока при дросселировании. Изменение параметров при дросселировании. Диффе-
ренциальный адиабатный дроссель-эффект. Точка инверсии. Кривая инерсии.
Методические указания. Какие допущения положены в основу вывода уравнения I закона термодинамики для потока? Назначение сопел. Надо уметь графически представлять располагаемую работу в p-v, T-s и
i-s диаграммах для реального и идеального газов. Что такое работа проталкивания и какой она может иметь знак? Особое внимание необходимо
обратить на выбор типа сопла и режима течения рабочего тела, максима-льный расход и критическую скорость течения. Зависимость скорости и расхода от отношения начального и конечного давления. Следует уяснить, в каких случаях полное расширение пара или газа до давления ок-ружающей среды, а в каких - неполное, как влияет форма канала на процесс течения, чем отличается расчет процессов течения с трением.
Процесс адиабатного дросселирования широко используется в технике, в частности в циклах холодильных машин. Поэтому необходимо хорошо представлять, в каких случаях в процессе дросселирования температура уменьшается, а в каких - остается неизменной.
Тема 10. Термодинамика газовых циклов.
Программа. Компрессор. Работа одноступенчатого компрессора. Изотермическое, адиабатное и политропное сжатие. Причины применения многоступенчатого сжатия. Работа компрессора в диаграммах p-v,
T-s. Двигатели внутреннего сгорания. Индикаторная диаграмма и цикл двигателя. Цикл с подводом тепла при v = const и его КПД. Цикл с подводом тепла при p = const и его КПД. Сравнение КПД циклов ДВС. Газотурбинные установки. Принципиальная схема и цикл ГТУ с подводом тепла при p = const. Термический КПД идеального цикла. Действительный цикл и его КПД. Методы повышения КПД циклов ГТУ. Повышение температуры газа перед турбиной. Регенерация тепла в цикле. Многоступенчатое сжатие и ступенчатый подвод тепла в цикле. Замкнутые схемы ГТУ. Рабочие тела замкнутых схем. Цикл ГТУ с подводом теплоты при
v = const.
Методические указания. Представить устройство и работу поршневого компрессора, двигателей внутреннего сгорания, газовых турбин. При анализе циклов компрессора уметь объяснить, почему процессы всасывания и выталкивания не являются термодинамическими процессами, почему нельзя сжимать газ в одной ступени до больших давлений. Почему надо стремиться к осуществлению изотермического сжатия газа и как к нему можно приблизиться. В чем сущность и экономическая целесооб-
разность многоступенчатого сжатия газа. Уметь графически изображать работу в p-v и T-s диаграммах.
При анализе циклов ДВС и ГТУ необходимо уметь графически представлять цикл в p-v и T-s диаграммах, уметь графически анализировать
экономичность циклов (влияние характеристик цикла на его термический КПД) и сравнивать различные циклы по экономичности. В чем заключается преимущество ГТУ перед ДВС? В чем разница между замкнутыми и разомкнутыми циклами ГТУ? Представлять смысл и значение регенера-
ции тепла, многоступенчатого сжатия газа и многоступенчатого подвода тепла. Уметь термодинамически оценивать эти явления (в чем получается выигрыш, а в чем проигрыш). Уметь рассчитывать произвольный цикл, в котором есть политропные процессы.
VI Модуль
Тема 11. Циклы паротурбинных и комбинированных установок.
Программа, Циклы ПТУ в диаграммах p-v, T-s, i-s. Принципиальная схема ПТУ. Термический КПД цикла ПТУ, методы повышения термического КПД. Применение пара высоких параметров. Действительный цикл с необратимым адиабатным расширением пара. КПД ПТУ. Удельные расходы пара, тепла, топлива. Вторичный перегрев пара, причины применения. Цикл со вторичным перегревом пара в p-v, T-s, i-s диаграм-мах. Принципиальная схема. Оптимальная температура начала вторичного перегрева пара. Цикл с двумя промежуточными перегревами.
Регенеративные циклы (идеальный и теоретический). Схема регенеративного подогрева с отбором пара. Изображение регенеративных циклов в p-v, T-s, i-s диаграммах. Термический КПД. Оптимальная температура подогрева питательной воды и максимальный КПД регенеративного цикла. Прирост КПД в зависимости от числа отборов.
Бинарный цикл и его КПД. Принципиальная схема бинарной паротурбинной установки. Комбинированные парогазовые циклы. Термический КПД. Термодинамические циклы атомных электростанций. Термодинамические основы теплофикации. Эксергетический и тепловой баланс ПТУ. Эксергетический КПД.
Методические указания. Цикл Карно для влажного пара и его недостатки. Почему паросиловые установки не работают по циклу Карно? Цикл Ренкина, изображение в p-v, T-s, i-s диаграммах. Уметь рассчитывать термический КПД по таблицам водяного пара и i-s - диаграмме.
Знать влияние начальных и конечных параметров на термический КПД цикла Ренкина. Знать методику расчета цикла Ренкина, вычисление уде-льных расходов пара и топлива. Уметь термодинамически оценивать сложные циклы(с промежутоным перегревом пара, с регенерацией тепла, теплофикационные и комбинированные циклы, циклы АЭС).
Представлять ясно, как изменяется полезная работа и затраченное тепло при осуществлении того или иного цикла в сравнении с циклом Ренкина. В цикле с промперегревом пара необходимо учитывать зависимость КПД
цикла от давления, при котором производится промперегрев, и правильно его выбирать. Всегда ли выгоден промперегрев?
Для регенеративного цикла необходимо разбираться в той экономической эффективности, которую от дает. Как зависит экономичность регенеративного цикла от числа отборов пара на регенерацию тепла? Предельно-регенеративный цикл и его КПД. В теплофикационных циклах необходимо разбираться в коэффициентах теплофикации и использовании тепла топлива. Знать, почему, несмотря на снижение термического КПД в теплофикационном цикле, метод совместной выработки тепла и электроэнергии является прогрессивным.
Необходимо во всех циклах подсчитывать подведенное и отведенное тепло, полезную работу цикла и его термический КПД. Необходимо уметь также изображать эти циклы, их тепло и работу в координатах p-v, T-s, i-s, а также уметь сравнивать циклы между собой и циклом Карно. Нужно хорошо разбираться в вопросах о потерях, протекающих в паросиловых установках, и в КПД, характеризующих эти потери энергии.
Тема 12. Циклы холодильных установок и термотрансформаторов тепла. Методы непосредственного преобразования теплоты
в электроэнергию.
Программа. Обратный цикл Карно. Холодильный коэффциент. Схе-има и цикл воздушной холодильной установки. Схема, цикл и холодильный коэффициент парокомпрессорной холодильной установки. Схема и принцип работы абсорбционной холодильной установки. Цикл теплового насоса - термотрансформатора. Отопительный коэффициент.Термо-динамическое сравнение теплового насоса и теплофикации. Схема, цикл, КПД установки с магнитогидродинамическим генератором. Термоэлектрические генераторы и их КПД.
Методические указания. Нужно представлять себе термодинамические основы получения холода и принцип работы различных холодильных установок. Какие требования предъявляются к холодильным агентам и чем эти требования обосновываются? Почему холодильные установки
не работают по обратному циклу Карно? В чем состоит смысл холодильного и отопительного коэффициентов? Какие недостатки имеет воздушная холодильная установка? Каков получается проигрыш в затраченной работе цикла при замене расширительного цилиндра (детандера) дроссельным вентилем в парокомпрессорной холодильной установке. Какие процессы заменяют процесс сжатия холодильного агента в пароэжектор-
ной и абсорбционной холодильных установках? Необходимо уметь изображать циклы холодильных установок и термотрансформаторов, их цик-
лы в T-s диаграмме, уметь вычислять работу и тепло, а также холодильные и отопительные коэффициенты.
2. КОНТРОЛЬНЫЕ ЗАДАНИЯ
I Модуль
Задача
Данный цикл в системе координат p-v, изображенный в номере варианта, совершаемый 1 кг газа.
1) дать доказательство в общем виде для всех характерных точек следующего равенства: 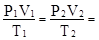 ... = const.
... = const.
Какова физическая сущность величины R?
Ее виды. Изобразить систему координат “абсолютное давление - удельный объем”, приемлемую для всех видов газов одновременно.
2) определить недостающие параметры состояния в характерных точках. Абсолютное и избыточное давление в барах, Па; температуру в К, удельный объем в  . В задании дано атмосферное давление
. В задании дано атмосферное давление
Р бар= 1 бар.
Результаты расчетов занести в таблицу
| N состояния | Р ман | Р вак | Р абс | v | T | Примеч. |
При определении той или иной величины необходимо написать какую величину определяете и по какой формуле. Если используете математическое выражение закона, то надо написать какой закон используете. Затем должна быть дана подстановка всех величин в правую часть этого выражения. И, наконец, дать результат с указанием размерности,
например: “Определить удельный объем в состоянии 5 по уравнению Клайперона:

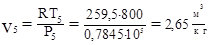
3) Начертить на миллиметровой бумаге заданный цикл в масштабе. Для построения линии T=const необходимо получить 2 промежуточные
точки. Для нахождения их можно, например, задаться величиной промежуточного давления и подсчитать величину удельного объема. Затем, пользуясь выбранным масштабом найти расположение точек, соответствующее выбранному давлению.
Вариант 1 Газ - Водород  Р1 = 588 мм рт.ст.; t1 = 27 0С
Р1 = 588 мм рт.ст.; t1 = 27 0С  ;
;
P2 = 4,0 
Р3 = 5885 мм рт.ст.; t4 = 3531 0C;
Вариант 2 Газ - Водород
Р1 = 622 мм рт.ст.; v2 = 4,83  ;
;
t3 = 369 0C; v4 = 10  ; P5 = 2,5
; P5 = 2,5  ;
;
Вариант 3 Газ - кислород
t2 = 27 0C; P3 = 2942 мм рт.ст.; v4 = 0,5  ; P4 = 5
; P4 = 5  ; v5 = 0,994
; v5 = 0,994  ;
;
Вариант 4 Газ - кислород
Р2 = 588,5 мм рт.ст.; v3 = 0,994  ;
;
P4 = 1,87  ; t4 = 727 0С;V5 = 2,65
; t4 = 727 0С;V5 = 2,65  ;
;
Вариант 5 Газ - кислород
V1 = 2,65  ; t2 = 127 0C; P3 = 4,8
; t2 = 127 0C; P3 = 4,8  ;
;
P4 = 735,6 мм рт.ст.; v4 = 6,36  ;
;
Вариант 6 Газ - кислород
t1 = 527 0C; P3 = 5885 мм рт.ст.;
t3 = 1327 0С;
P4 = 12  ; V5 = 2,65
; V5 = 2,65  ;
;
Вариант7 Газ - кислород
v1 = 26,5  ; t2 = 527 0C; v3 = 0,265
; t2 = 527 0C; v3 = 0,265  ;
;
P4 = 1765,4 мм рт. ст.; t5 = 2127 0C;
Вариант 8 Газ - водород
t1 = 527 0C; P5 = 1  ; v3 = 21,3
; v3 = 21,3 
P2 = 588,5 мм рт.ст.; t4 = 2127 0С;
Вариант 9 Газ - водород
v1 = 42,06  ; P2 = 5885 мм рт.ст.;
; P2 = 5885 мм рт.ст.;
t2 = 527 0C; t5 = 2127 0C; v4 = 8,412 
Вариант 10 Газ - водород
t1 = 527 0C; P5 = 1765,4 мм рт.ст.;
v3 = 4,206  ; P3 = 16
; P3 = 16  ;
;
v4 = 6,309  ;
;
Вариант 11 Газ - водород
Р1 = 588,5 мм рт.ст.; t2 = 527 0C;
v3 = 4,206  ; t4 = 1327 0C;
; t4 = 1327 0C;
v4 = 21,03  .
.
Вариант 12 Газ - водород
Р1 = 588,5 мм рт.ст.; t2 = 527 0C;
v4 = 16,824  ; t5 = 2127 0C;
; t5 = 2127 0C;
P3 = 1 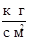 ;
;
Вариант 13 Газ - кислород
t1 = 27 0C; P2 = 2648 мм рт.ст.;
t3 = 1357 0C; P4 = 2  ; t5 = 393 0C;
; t5 = 393 0C;
Вариант 14 Газ - кислород
Р1 = 588,5 мм рт.ст.; t2 = 27 0C;
v3 = 0,198  ; P4 = 6
; P4 = 6  ; t5 = 30 0C;
; t5 = 30 0C;
Вариант 15 Газ - кислород
v1 = 17,35  ; t2 = 57 0C; P2 = 3,2
; t2 = 57 0C; P2 = 3,2  ;
;
v3 = 10  ; P4 = 2207 мм рт.ст.;
; P4 = 2207 мм рт.ст.;
Вариант 16 Газ - азот
v1 = 1,136  ; t2 = 27 0C;
; t2 = 27 0C;
P3 = 2942 мм рт.ст.;
v4 = 1  ; t5 = 1062 0C;
; t5 = 1062 0C;
Вариант 17 Газ - азот
Р1 = 588 мм рт.ст.; v3 = 1,136  ;
;
P4 = 1,87  ; t5 = 727 0C;
; t5 = 727 0C;
P5 = 735,6 мм рт.ст.;
Вариант 18 Газ - азот
Р1 = 588,5 мм рт.ст.; Р3 = 4,8  ;
;
t3 = 2127 0C;
v4 = 7,272  ; v5 = 3,03
; v5 = 3,03  ;
;
Вариант 19 Газ - азот
V1 = 3,03  ;
;  P2 = 5885 мм рт.ст.;
P2 = 5885 мм рт.ст.;
t2 = 527 0C;
P4 = 12  ; v4 = 0,606
; v4 = 0,606  ;
;
Вариант 20 Газ - азот t1 = 527 0C; v2 = 0,303  ; P4 = 16
; P4 = 16  ;
;
t4 = 2127 0C; P5 = 1765,4 мм рт.ст.;
Вариант 21 Газ - азот
Р2 = 8  ; t2 =527 0C; t4 = 1327 0C;
; t2 =527 0C; t4 = 1327 0C;
v4 = 1,515  ; t5 = 2927 0C;
; t5 = 2927 0C;
Вариант 22 Газ - азот
v1 = 9,09  ; v3 = 3,03
; v3 = 3,03  ; P4 = 1
; P4 = 1  ;
;
t4 = 127 0C; P5 = 4414 мм рт.ст.;
Вариант 23 Газ - азот
V1 = 9,09 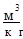 ; t3 = 227 0C; v3 = 1,515
; t3 = 227 0C; v3 = 1,515 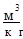 ;
;
P5 = 2207 мм рт.ст.; v5 = 2,424 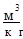 ;
;
Вариант 24 Газ - азот
Р1 = 588,5 мм рт.ст.; P3 =16  ;
;
t3 = 2927 0C;
v5 = 6,06  ; t5 = 1727 0C;
; t5 = 1727 0C;
Вариант 25 Газ - азот
P1 = 588,5 мм рт.ст.; t1 = 127 0C;
P3 = 8  ;
;
v3 = 0,606  ; t5 = 227 0C;
; t5 = 227 0C;
II Модуль
Задача.
Определить тепло, необходимое для нагрева смеси газов в интервале температур от t1 до t2. При расчете учесть зависимость теплоемкости от температуры:
а) нелинейная,
б) линейная.
Решить также задачу при условии, что теплоемкость не зависит от температуры.
Данные для решения задачи выбрать из табл. 1.
Таблица 1
| Вариант | |||||
| Смесь газов | mN2 = 0,7 mO2 = 0,2 mH2O = 0,1 | rN2 = 0,65 rO2 = 0,25 rH2O = 0,1 | mN2 = 0,6 mCO = 0,2 mH2O = 0,2 | rO2 = 0,63 rCO = 0,22 rH2O = 0,15 | mN2 = 0,5 mCO2 = 0,2 mO2 = 0,1 mH2O = 0,2 |
Объем, 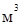
| |||||
| Масса, кг | |||||
| Начальное давление, бар | 3,0 | 4,0 | 5,0 | ||
| Нач. темпе-ратура, 0С | |||||
| Конеч. тем-пература, 0С | |||||
| Характер процесса | p = const | v = const | p = const | v = const | p = const |
| Вариант | |||||
| Смесь газов | rN2 = 0,55 rCO = 0,25 rO2 = 0,15 rH2O = 0,05 | mN2 = 0,4 mCO = 0,3 mO2 = 0,2 mH2O = 0,1 | rN2 = 0,75 rCO2 = 0,15 rH2O = 0,1 | mN2 = 0,7 mCO = 0,2 mSO2 = 0,1 | rN2 = 0,65 rH2O = 0,25 rSO2 = 0,1 |
Объем, 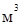
| |||||
| Масса, кг | |||||
| Нач. давле-ние, бар | 6,0 | 4,0 | |||
| Нач. темпе-ратура, 0С | |||||
| Конеч. тем-пература, 0С | |||||
| Характер процесса | v = const | p = const | v = const | p = const | v = const |
| Вариант | |||||
| Cмесь газов | mN2 = 0,6 mSO2 = 0,2 mH2O = 0,2 | rN2 = 0,63 rH2O = 0,22 rSO2 = 0,15 | mN2 = 0,5 mH2O = 0,2 mSO2 = 0,1 mO2 = 0,2 | rN2 = 0,55 rH2O = 0,25 rSO2 = 0,15 rO2 = 0,05 | mN2 = 0,4 mH2O = 0,3 mSO2 = 0,2 mO2 = 0,1 |
Объем, 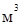
| |||||
| Масса, кг | |||||
| Нач.давле-ние, бар | 5,0 | 6,0 | 7,0 | ||
| Нач. темпе-ратура, 0С | |||||
| Конеч. тем-пература, 0С | |||||
| Характер процесса | v = const | p= const | v = const | p = const | v = const |
| Вариант | |||||
| Смесь газов | rN2 = 0,75 rH2O = 0,15 rSO2 = 0,1 | mN2 = 0,3 mH2O = 0,3 mSO2 = 0,2 mO2 = 0,2 | rN2 = 0,8 rH2O = 0,1 rSO2 = 0,1 | mN2 = 0,7 mCO = 0,2 mO2 = 0,1 | rN2 = 0,6 rCO = 0,2 rO2 = 0,2 |
Объем, 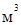
| |||||
| Масса, кг | |||||
| Нач.давле-ние, бар | 8,0 | 2,5 | |||
| Нач. темпе-ратура, 0С | |||||
| Конеч. тем-пература, 0С | |||||
| Характер процесса | p = const | v = const | p = const | p = const | p = const |
| Вариант | |||||
| Смесь газов | mN2 = 0,5 mCO = 0,2 mO2 = 0,1 mSO2 = 0,2 | rN2 = 0,4 rCO = 0,3 rO2 = 0,2 rSO = 0,1 | mN2 = 0,3 mCO = 0,3 mO2 = 0,2 mSO2 = 0,2 | rN2 = 0,65 rO2 = 0,25 rCO = 0,1 | rN2 = 0,63 rO2 = 0,22 rCO = 0,15 |
Объем, 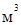
| |||||
| Масса, кг | |||||
| Нач. давле-ние, бар | 3,5 | 4,5 | 0,8 | ||
| Нач. темпе-ратура, 0С | |||||
| Конеч. тем-пература, 0С | |||||
| Характер процесса | p = const | p = const | p = const | v = const | v = const |
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 679; Нарушение авторских прав?; Мы поможем в написании вашей работы!