
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй закон Фарадея
|
|
|
|
При отсутствии внешнего электрического поля ионы и нейтральные молекулы находятся в тепловом хаотическом движении. Если в раствор поместить два электрода, подсоединённые к двум различным полюсам источника тока, то на тепловое движение ионов накладывается упорядоченное движение ионов под действием электрического поля. Положительные ионы (катионы) движутся к катоду, отрицательные (анионы) – к аноду. По раствору начинает протекать электрический ток.
БилетNo 13
1. Электрический ток в электролитах. Закон электролиза. Применение электролиза в технике. При растворении в воде солей, оснований и кислот, вследствие большой диэлектрической проницаемости воды, кулоновские силы ослабевают и молекулы этих веществ распадаются на ионы.
Распад молекул растворяемого вещества на ионы под действием молекул растворителя называется электролитической диссоциацией.
Наряду с диссоциацией идёт обратный процесс – рекомбинация, т.е. восстановление молекул.
Например: CuSO4ÛCu+++SO4--
Растворы и расплавы солей, кислот и оснований, которые проводят электрический ток, называются электролитами. Характер проводимости электролитов – ионный.
Электролиты обладают сопротивлением. Для них выполняются законы Ома и Джоуля-Ленца.
При прохождении электрического тока через электролит на электродах выделяются составные части электролита. Это явление называется электролизом. Например: CuSO4ÛCu+++SO4--
Cu++ + 2 е Þ Cu – отложение меди на катоде
SO4-- - 2 е Þ SO4 - реакция на аноде.
Если анод выполнен из меди, то группа SO4 вступает в реакцию с медью анода
SO4 + Cu Þ CuSO4
Молекула CuSO4 выходит в раствор. Происходит растворение анода и отложение меди на катоде.
Зависимость между количеством выделившегося вещества и количеством прошедшего электричества установил Фарадей.
Первый закон Фарадея.
Масса вещества m, выделившегося на каком-либо из электродов, прямо пропорциональна заряду q, прошедшему через электролит.
m=Kq=KI Dt
где I – сила тока, Dt – время протекания тока через раствор, K электрохимический эквивалент вещества, который численно равен массе вещества, выделившегося на электроде при прохождении заряда в 1 Кл.
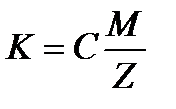
Электрохимический эквивалент пропорционален химическому эквиваленту данного вещества.
где M – молярная масса вещества, Z – валентность, С=1/F – коэффициент пропорциональности.
F=96500 Кл/моль – постоянная Фарадея, численно равная заряду, который должен пройти через электролит, чтобы на электроде выделился один моль одновалентного вещества.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 918; Нарушение авторских прав?; Мы поможем в написании вашей работы!