
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет процесса конверсии
|
|
|
|
Рассчитать процесс конверсии метана водяным паром по следующим данным:
| Производительность по метану | 1000 м3/час |
| Состав газа | метан – 98% |
| азот – 2% | |
| Степень конверсии | 70% |
| Температура | на входе 105°С |
| на выходе 900°С |
СН 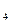 + Н
+ Н 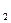 О
О  СО + 3Н
СО + 3Н 

1. Расчет термодинамических параметров.
СН 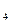
| Н 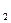 О О
| СО | Н2 | |
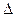 Н Н  
| -74,85 | -241,81 | -110,53 | |
DS  
| 186,27 | 188,72 | 197,55 | 130,52 |
DG  
| -50,85 | -228,61 | -137,15 |
1.1. По закону Гесса находим тепловой эффект химической реакции при нормальных условиях:
DН  =(Sni DН
=(Sni DН  )
) 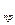 - (Sni DН
- (Sni DН  )
) 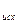
DН  = 0×3 - 110,53 + 241,81 + 74,85 = 206,13 кДж/моль
= 0×3 - 110,53 + 241,81 + 74,85 = 206,13 кДж/моль
1.2. Найдем энтропию реакции:
DS  = (SniDS
= (SniDS  )
) 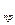 - (SniDS
- (SniDS  )
) 
DS  =3×130,52 +197,55 -188,72 -186,27= 214,12 Дж/моль×К
=3×130,52 +197,55 -188,72 -186,27= 214,12 Дж/моль×К
1.3. Найдем изменение энергии Гиббса в ходе реакции при нормальных условиях:
DG  = (SniDG
= (SniDG  )
)  -(SniDG
-(SniDG  )
) 
DG  = 3×0-137,15+288,61+50,85=142,31 кДж/моль
= 3×0-137,15+288,61+50,85=142,31 кДж/моль
2. Найдем функцию зависимости теплоемкости от температуры С  = f(Т)
= f(Т)
СН 
| Н  О О
| СО | Н 
| |
| a | 14,32 | 28,41 | 27,28 | |
| b | 74,66×10 
| 10,71×10 
| 4,1×10 
| 3,26×10 
|
| с’ | 0,33×10 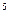
| -0,46×10 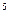
| 0,5×10 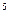
| |
| с | -17,43×10 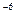
|
Ср(СН4) = 14,32 + 74,66×10  Т - 17,43×10
Т - 17,43×10 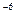 Т
Т 
Ср(Н2О) = 30 + 10,71×10-3Т + 0,33×105Т-2
Ср(СО) = 28,41+ 4,1×10-3×Т - 0,46×105Т-2
Ср(Н2) = 27,28 + 3,26×10-3Т + 0,5×105Т-2
DСр = Dа + DbT + Dс’Т2+DcТ-2
DСр = (3×27,28+28,41-30-14,32) + (3×3,26+4,1-10,71-74,66)×10-3Т +
+ (3×0,5-0,46-0,33)×105Т-2 - 17,43×10-6Т2
DСр = 65,93 - 71,49×10-3Т + 0,71×105Т-2 - 17,43×10-6Т2 Дж/моль×К
2.1. Для азота зависимость теплоемкости от температуры выглядит следующим образом:
Ср(N2) = 27,88 + 4,27×10-3Т
3.1. Найдем изменение энтропии в ходе реакции при нагревании от t1=25 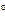 C до t2=900
C до t2=900 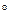 C:
C:
DS= 
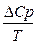 dТ =
dТ =

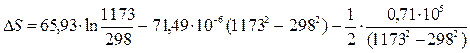
DS=16.54 Дж/моль×К
3.2. Найдем изменение энтальпии в ходе реакции при нагревании от t1=25°C до t2=900°C:

DH= 65,93 (1173-298) -  ×71,49×10-3(11732-2982) -
×71,49×10-3(11732-2982) - 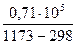 -
- 
DН= - 2375 Дж/моль
3.3. Рассчитаем энергию Гиббса на выходе t2=900°С:

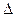
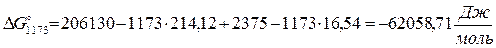
4. Найдем константу равновесия:
DG°=-RTlnKp
Kp = exp(-DG°/RT)
Kp=exp(-(-62058,71/8,31×1173))=582,04
4.1. Рассчитаем равновесную степень превращения метана. При температуре от 827°С и составе исходной смеси СН4 : Н2О = 1: 2 необходимо проводить процесс при абсолютном давлении 10 атм.
СН4 + Н2О ® СО + 3Н2
т.к. водяной пар в избытке, то РН2О = 2РСН4
Робщ = РСН4 + 2РСН4= 3РСН4
РСН4 = Робщ/3 = 10/3 атм.
При равновесии:
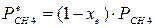





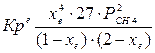

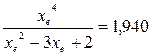
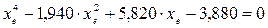
xe = 0,8115 и xe = - 2,29
Равновесная степень превращения равна 0,8115.
Вывод: равновесная степень превращения метана xe=0,8115,степень конверсии a = 0,7, данный процесс, возможно, провести в указанных условиях.
5. Составим материальный баланс.
| Приход | Расход | ||||
| Исходное вещество | m, кг | V,м3 | Продукт | m, кг | V,м3 |
| СН4 | 714,29 | СН4 | 214,29 | ||
| N2 | 25,51 | 20,41 | N2 | 25,51 | 20,41 |
| Н2О | 1607,14 | Н2О | 1044,64 | ||
| СО | |||||
| Н2 | 187,5 | ||||
| Итого: | 2346,94 | 3020,41 | Итого: | 2346,94 | 4420,41 |
5.1.Найдем количество поступающего метана (в час):
по закону эквивалентов

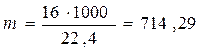 (кг)
(кг)
Найдем количество конвертируемого метана:
V=0, 7×1000=700 (м3)
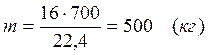
После реакции осталось:
m(СН4) = 714,29 – 500 = 214,29 (кг)
V(СН4)= 1000 – 700 = 300 (м3)
5.2. Найдем необходимое количество воды для осуществления реакции:

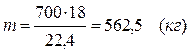
В промышленном производстве для осуществления процесса воду и метан берут в отношении 2:1. Исходя из этого условия рассчитаем количество поступающего водяного пара:
V = 2 × 1000 = 2000 (м3)
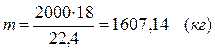
Не прореагировало водяного пара:
m(Н2О) = 1607,14 – 500 = 214,29 (кг)
V(Н2О) = 2000 – 700 = 300 (м3)
5.3. В реактор поступает  :
:
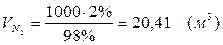
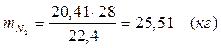
Т.к. азот не участвует в химической реакции, то на выходе:
m = 25,51 (кг)
V = 20,41 (м3)
5.4. Найдем количество образовавшегося в ходе реакции СО:
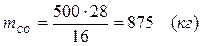

5.5. Найдем количество образовавшегося водорода:
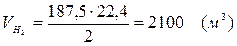
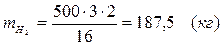
Вывод: 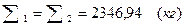 . Материальный баланс сошелся.
. Материальный баланс сошелся.
6. Составим энергетический баланс:
| Приход | кДж | % | Расход | кДж | % |
| Q(СН4) | 675,87 | Q(СН4) | 1224,04 | 7,2 | |
| Q(N2) | 10,16 | 0,06 | Q(N2) | 35,15 | 0,2 |
| Q(Н2О) | 1156,9 | 6,87 | Q(Н2О) | 4460,2 | 26,4 |
| Qподв | 15029,6 | 89,07 | Q(СО) | 1216,5 | 7,23 |
| Q(Н2) | 3420,87 | 20,24 | |||
| Qх.р. | 6515,8 | 38,62 | |||
| Итого: | 16872,53 | 100% | Итого: | 16872,56 | 100% |
6.1. Найдем тепло, которое поступает с исходными веществами – физическое тепло:

где T1 – температура на входе, (t1=105 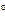 C); Ср – теплоемкость, будем считать, что теплоемкость зависит от температуры (п.2).
C); Ср – теплоемкость, будем считать, что теплоемкость зависит от температуры (п.2).

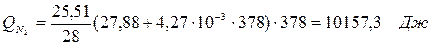

Реакция конверсии водяным паром сильно эндотермична, поэтому необходимо подогревать исходную реакционную смесь. В промышленности для подогрева системы используют природный газ, за счет сжигания которого выделяется необходимое количество тепла Q.
6.2. Найдем тепло веществ на выходе из реактора:

где T2 – температура на выходе из реактора.

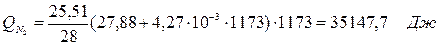
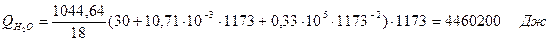


6.3. Найдем теплоту, поглощенную в ходе химической реакции:
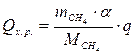


6.4. Найдем количество теплоты, которое необходимо затратить на подогрев исходной смеси:
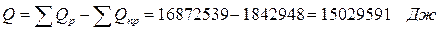
6.5. Найдем количество природного газа, которое необходимо затратить для подогрева исходной смеси, считая, что природный газ на 95% состоит из метана (состав природного газа зависит от месторождения, колеблется от 55-99%):
По справочнику:
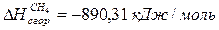
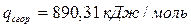



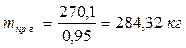
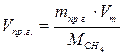

СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. А. Г. Аншиц, Е. Н. Воскресенская. Окислительная конденсация метана – новый процесс переработки природного газа.
2. Сосна М.Х., Энтин Б.М., Лейтес И.Л. Нонограммы для определения состава газа конверсии метана//Химическая промышленность. – 1989. - №7. - с.59
3. Крейндель Э.М. Конверсия метана природного газа. Л.:-1964.
4. Г.С. Яблонский. Кинетические модели гетерогенно-каталитических реакций. Элементы теории кинетики сложных химических реакций. Глава 1. В сб.: Химическая и биологическая кинетика / Под ред. Н.М. Эмануэля, И.В. Березина, С.Д. Варфоломеева. М.: Изд-во Моск. ун-та, 1983.
5. Водород. Свойства, получение, хранение, транспортирование, применение: Справ. изд./Д.Ю. Гамбург, В.П. Семенов,, Л.Н. Смирнова; Под ред. Д.Ю. Гамбурга, Н.Ф. Дубовкина. – М.: Химия, 1989.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1449; Нарушение авторских прав?; Мы поможем в написании вашей работы!