
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства
|
|
|
|
В виду того, что находящиеся в таутомерном равновесии разные формы моносахаридов содержат сильно отличающиеся по характеру функциональные группы, химические свойства этих веществ будут определяться наличием этих таутомерных форм с присущими им функциональными группами. Оксоформы углеводов содержат оксогруппу (альдегидную или кетонную), поэтому моносахариды могут вступать в реакции с участием оксогруппы именно в открыто-цепной форме (оксоформе). Наоборот, циклические формы, являясь полуацеталями, проявляют свойства этого класса соединений, вступая в реакции с участием полуацетальной гидроксильной группы. А так как в молекулах углеводов имеются и гидроксогруппы многоатомных спиртов (как в оксоформах, так и в циклических формах), то свойства этого класса соединений моносахариды проявляют, находясь в любой таутомерной форме.
7.1.2.1. Реакции открыто-цепных форм
Моносахариды, являясь полигидрокси карбонильными соединениями, вступают в реакции с участием карбонильной группы, прежде всего, это реакции нуклеофильного присоединения.Примерами могут служить реакции с гидроксиламином, с гидросульфитом натрия.
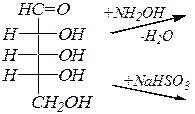 D- рибоза
D- рибоза
| 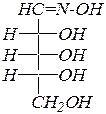
|
| оксим D- рибозы | |
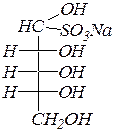
| |
| бисульфитное производное D- рибозы |
Аналогично реакция протекает с эквимолекулярным количеством фенилгидразина. Однако с избытком этого реагента реакция протекает иначе. С первой молекулой образуются обычные для карбонильных соединений фенилгидразоны:
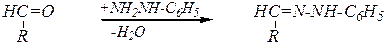 ,
,
которые при нагревании вступают в SN -реакцию со второй молекулой фенилгидразина, а в последующем дегидрировании принимает участие третья молекула реагента. При этом образуются озазоны. Нетрудно видеть, что эпимерные манноза и глюкоза образуют одинаковые продукты:
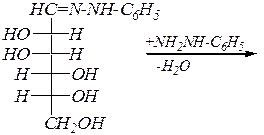
| 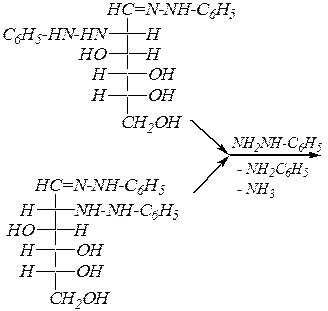
|
| фенилгидразон D -маннозы | |
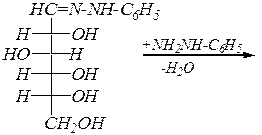 фенилгидразон D -глюкозы
фенилгидразон D -глюкозы
|
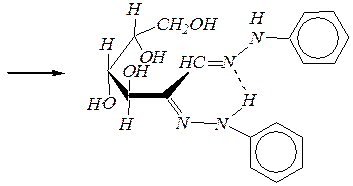
Озазоны — жёлтые кристаллические вещества, структура их молекул стабилизирована длинной цепью сопряжения и внутримолекулярной водородной связью.
Образование озазонов используют для идентификации углеводов. Для каждого углевода характерна определённая скорость образования озазона, например: озазон фруктозы выделяется из раствора за 2 мин., озазон глюкозы — за 4 – 5 мин., озазон ксилозы — за 7 мин. и т.д. Впервые озазоны синтезированы Э. Фишером в 1887 г.
При нагревании со щелочью происходит изомеризация альдоз в кетозы (и обратно) и в эпимерные альдозы через енольную форму. Например, превращения D -глюкозы, D -фруктозы и D -маннозы:
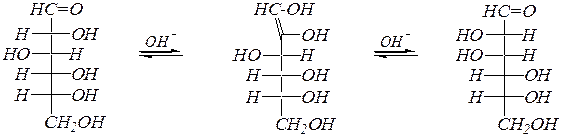
| ||
| D -глюкоза | 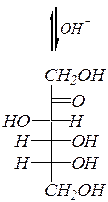 D -фруктоза
D -фруктоза
| D -манноза |
Реакции восстановления оксогруппы также возможны только в оксоформе, и они приводят к соответствующим многоатомным спиртам. Восстановление проводят водородом на металлических катализаторах. При этом из кетоз образуется смесь эпимерных спиртов. Например:
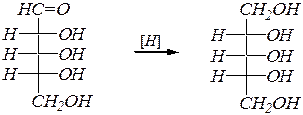
D -рибоза D -рибит
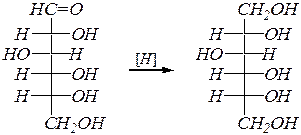
D -глюкоза D -глюцит
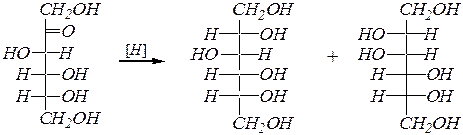
D -фруктоза D -глюцит D -маннит.
Данные многоатомные спирты называют с использованием суффикса - ит.
Альдозы легко подвергаются окислению по свободной альдегидной группе. Так, под действием мягких окислителей, например бромной воды, образуются альдоновые кислоты, которые обычно существуют в виде d- или g-лактонов.
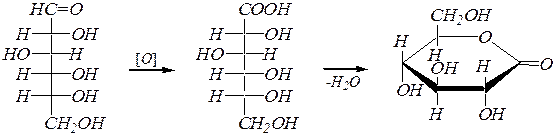
D -глюконовая кислота и её d-лактон
Кроме бромной воды для получения альдоновых кислот могут использоваться реактив Толленса (реакция серебряного зеркала), свежеосаждённый гидроксид меди (II) (или гидроксид меди в виде реактива Фелинга) (гл. 4.4.2 и 6.1.4.3). Окисление альдоз до альдоновых кислот протекает обычно в кислой или нейтральной среде. Однако при использовании для этих целей разбавленной азотной кислоты окисление может пойти дальше (в зависимости от концентрации кислоты) и образуются «аровые» (полное общее название гликаровые) кислоты, в молекулах которых окислены оба концевых атома углерода. Например:
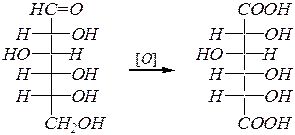
D -глюкаровая кислота.
А при окислении только первичноспиртовой группы могут быть получены альдегидокарбоновые кислоты, так называемые уроновые кислоты. Но такое окисление обычно возможно только для циклических форм моносахаридов с защищённой полуацетальной группой, поэтому будет рассмотрено несколько позже.
Окисление в щелочной среде сопровождается изомеризацией альдоз в кетозы и обратно и, в том числе, эпимеризацией, например, глюкозы в маннозу и обратно (см. выше). Поэтому в этих условиях могут окисляться и кетозы, предварительно изомеризуясь, образуя альдоновые кислоты. Например, использование реактива Толленса для окисления D -глюкозы (или D -фруктозы) приводит к получениюне только D -глюконовой кислоты, а смеси продуктов, содержащей, в том числе и D -манноновую кислоту.
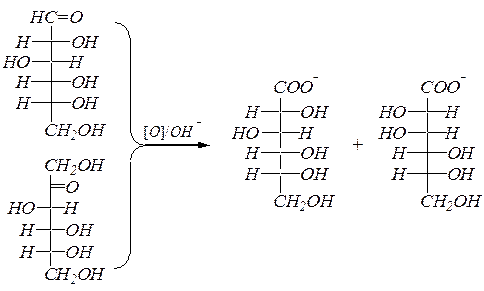
7.1.2.2. Реакции циклических форм
Как уже было показано выше, полуацетальные (гликозидные) гидроксильные группы присутствуют в циклических (полуацетальных) формах молекул моносахаридов. Поэтому превращения циклических форм связаны со свойствами полуацеталей, вообще, и с особенностями поведения таких гидроксогрупп, в частности, так как помимо полуацетального гидроксила в молекулах моносахаридов присутствует несколько спиртовых гидроксильных групп.
Полуацетальная гидроксильная группа обладает повышенной реакционной способностью: легко реагирует, например, со спиртами в условиях кислотного катализа с образованием полных ацеталей, называемых также в химии углеводов гликозидами. Это превращение находит отражение и в названии продукта: суффикс с окончанием - оза заменяется суффиксом
- озид.
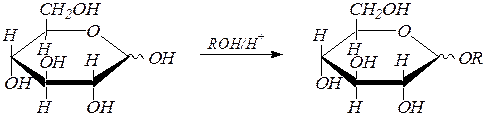
a(b), D- глюкопираноза алкил-a(b), D- глюкопиранозид
(В данном случае в реакцию вступает либо смесь a- и b-аномеров, либо одна из этих циклических форм, неважно какая. Образуется при этом смесь аномеров).
Несахарный фрагмент гликозида называют агликоном. Если агликон связан с остатком моносахарида через атом кислорода, то такой гликозид называют О- гликозидом, если через атом азота — N- гликозидом. (Например, при реакциях с аминами образуются N- гликозидные связи.)
Для получения О -алкилгликозидов обычно используют спирты, насыщенные сухим хлороводородом. Механизм реакции здесь, скорее всего, SN 1 ¾ так же, как и при образовании полных ацеталей из простых альдегидов и кетонов (гл. 6.1.4.1), так как промежуточный карбокатион стабилизирован р-р- сопряжением с участием неподелённой пары электронов атома кислорода пиранозного кольца:
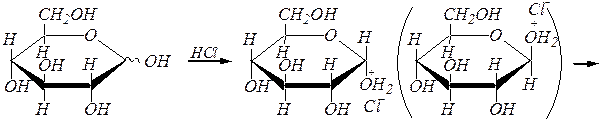
a(b), D- глюкопираноза
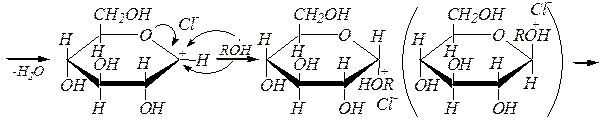
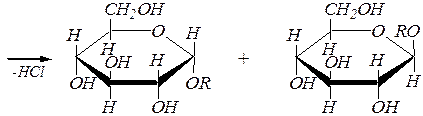
алкил-a, D- глюкопиранозид алкил-b, D- глюкопиранозид.
Образующиеся гликозиды, являясь полными ацеталями, гидролизуются в кислой среде, но устойчивы при действии разбавленных щелочей:
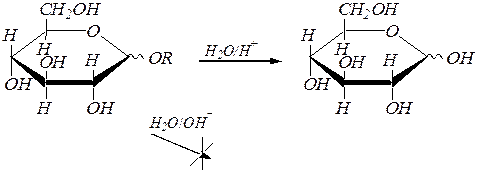
В условиях реакции алкилирования спиртов ¾ при обработке их щелочными растворами диметилсульфата (CH3)2SO4 (метилирование) или йодалканов образуются простые эфиры с участием всех спиртовых гидроксогрупп и гликозидного гидроксила тоже. Эта реакция ¾ типичное нуклеофильное замещение, в котором субстратами являются диметилсульфат или галогеналканы, протекающее, видимо, по механизму, близкому к SN 2. Например:
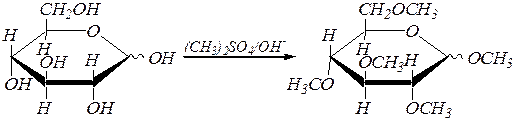
a(b), D- глюкопираноза метил-2,3,4,6-тетра- О -метил-a, D- глюкопиранозид
и метил-2,3,4,6-тетра- О -метил-b, D- глюкопиранозид.
Образующиеся простые эфиры гидролизу не подвергаются, а гликозидная группа легко гидролизуется в кислой среде, аналогично рассмотренному выше.
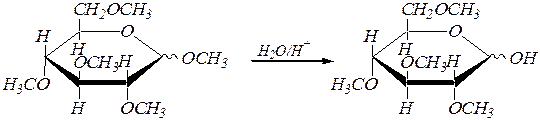
2,3,4,6-тетра- О -метил-a, D- глюкопираноза
и 2,3,4,6-тетра- О -метил-b, D- глюкопираноза.
Реакции ацилирования моносахаридов протекают с участием ангидридов или галогенангидридов карбоновых кислот. При этом также образуется смесь a и b-аномеров. Образующиеся сложные эфиры полностью гидролизуются как в кислой, так и в щелочной среде. Например:
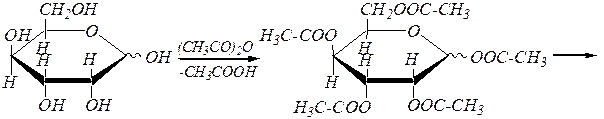
a(b), D- тулопираноза ацетил-2,3,4,6-тетра- О -ацетил-a(b), D- тулопиранозид
или a(b) -D- тулопираноза пентаацетат
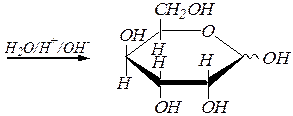
a, D- тулопираноза и b, D- тулопираноза.
Окисление первичноспиртовой группы (без участия альдегидной группы альдоз), протекающее в фиксированных циклических формах, т.е. для гликозидов моносахаридов, приводит к образованию уроновыхкислот. Например:
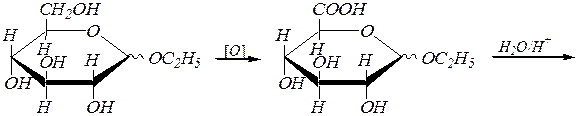
этил-a(b), D- глюкопиранозид
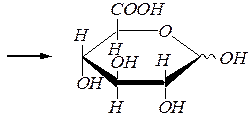
a(b) -D- глюкуроновая кислота.
7.1.2.3. Реакции дегидратации
При нагревании моносахаридов с минеральными кислотами может происходить внутримолекулярная дегидратация. В частности, ксилоза в водных растворах серной кислоты теряет три молекулы воды, и в результате образуется фурфурол(2-фуранкарбальдегид).
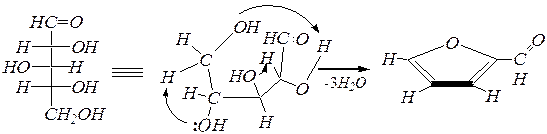
D- ксилоза фурфурол.
Подобные превращения с образованием гидроксиметилфурфурола могут происходить с некоторыми альдо- и кетогексозами.
7.1.2.4. Реакции удлинения и укорочения углеродной цепи
Реакции постепенного наращивания углеродной цепи и, наоборот, постепенного укорочения её (т.е. переходы триоза ® тетроза ® пентоза ® гексоза ® гептоза и обратно) имеют большое значение для установления строения моносахаридов.
Углеродная цепь наращивается циангидринным методом. Например, при превращении альдопентозы в альдогексозу химизм можно представить в следующем виде:
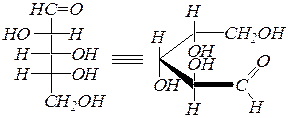
| 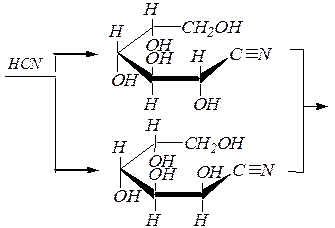
|
| D -арабиноза | |
| нитрилы D- глюконовой и D- манноновой кислот |
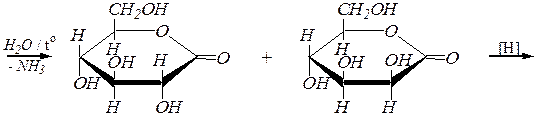
лактоны D- глюконовой и D- манноновой кислот
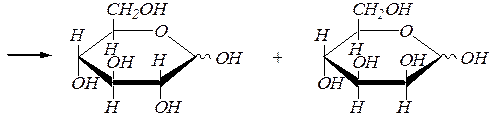
D- глюкоза D- манноза.
Укорочение углеродной цепи альдоз происходит в результате окисления альдегидной группы и последующего окислительного декарбоксилирования образовавшейся гликоновой кислоты с помощью специфического реагента. Например:
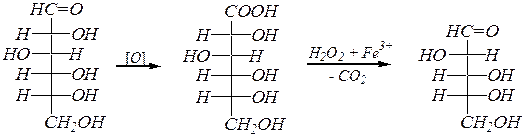
D- глюкоза D- глюконовая кислота D- арабиноза.
7.1.3. важнейшие представители моносахаридов
и их производных
D-Глюкоза (виноградный сахар) – самый распространённый моносахарид. В свободном виде содержится во фруктовых соках, в качестве составной части входит в состав многих дисахаридов и полисахаридов. В кристаллическом состоянии можно получить оба аномера: a- и b-пиранозные формы; в водном растворе содержание a-пиранозной формы 36%. Температура плавления безводной a- D- глюкопиранозы 419 К, b- D- глюкопиранозы ¾ 421 ¸ 423 К.
Глюкозу используют в пищевой промышленности, медицине, в качестве исходного вещества для получения глюконовой и аскорбиновой кислот, а также для получения этилового спирта. Этанол образуется в результате ферментативного расщепления. (Этот процесс, протекающий в клетке, называется гликолизом и является одним из путей окисления глюкозы). В промышленном производстве этанола используется процесс спиртового брожения под действием смеси ферментов — зимазы. Эту смесь ферментов вырабатывают дрожжевые грибы. Суммарно процесс превращения D- глюкозы в этанол можно выразить уравнением:
C6H12O6 ® 2 C2H5OH + 2 CO2.
Помимо D- глюкозы процессу спиртового брожения с участием ферментов дрожжевых грибов подвержены D- манноза и D- фруктоза.
D-Галактоза встречается в природе в свободном виде сравнительно редко, в виде гликозидов, дисахаридов (лактоза), полисахаридов (галактаны, агар-агар, растительные клеи), гликопротеинов, гликолипидов. В кристаллическом состоянии получены оба аномера: a- и b-пиранозные формы; в водном растворе содержание a-пиранозной формы 27%. Температура плавления безводной a- D- галактопиранозы 440 К, b- D- галактопиранозы 426 ¸ 428 К.
D-Фруктоза (плодовый сахар, левулоза) встречается в природе в свободном виде в пчелином мёде, в помидорах, яблоках, в виде дисахаридов (сахароза), некоторых полисахаридов, гликопротеинов. В кристаллическом состоянии существует в виде b-пиранозы с температурой плавления 375 ¸ 377 К; в водном растворе содержание фуранозных форм 23 – 42% в зависимости от температуры. В сахарозе и других производных присутствует в форме b-фуранозы.
D-Ксилоза (древесный сахар) входит в состав полисахаридов ксиланов. Ксиланы содержатся в древесине, лузге подсолнуха, кукурузной кочерыжке, соломе. D- ксилоза имеет температуру плавления 418 К; в кристаллическом состоянии существует в a-пиранозной форме, в водном растворе содержание a-пиранозной формы 33%.
D-Рибоза входит в состав рибонуклеиновой кислоты, нуклеотидов, витаминов, коферментов. Температура плавления 360 К; в кристаллическом состоянии существует в b-пиранозной форме, а в водном растворе содержание a-пиранозной формы 26%, b-пиранозной формы 50%, a-фуранозной формы 6% и b-фуранозной формы 13%. Производные D -рибозы имеют b-фуранозную форму.
Дезоксисахара, такие как, 2-дезокси- D -рибоза (2-дезокси-b, D -рибофураноза), L -фукоза, L -рамноза, – моносахариды, содержащие в молекуле один или несколько атомов водорода вместо гидроксильных групп.

2-дезокси-b, D -рибофураноза L -фукоза L -рамноза.
2-Дезокси- D -рибофураноза является структурным компонентом ДНК. L -Фукоза и L -рамноза – структурные компоненты гликозидов и полисахаридов наземных растений. L -Фукоза содержится также в составе биологически важных гликопротеинов и гликолипидов животных.
Аминосахара (или, правильнее, аминодезоксисахара), такие как, D -глюкозамин и N- ацетил- D -галактозамин и др. – производные моносахаридов, содержащие в молекуле вместо одной или нескольких гидроксильных групп незамещённые и замещённые аминогруппы.
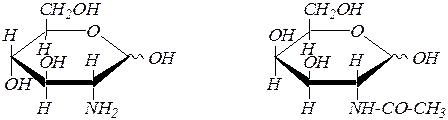
a(b), D -глюкозамин N- ацетил-a(b), D -галактозамин
(2-амино-2-дезокси- D -глюкопираноза) (2-ацетиламино-2-дезокси- D -галактопираноза).
Аминосахара входят в состав многих углеводсодержащих биополимеров, а также антибиотиков.
Нейраминовая и сиаловые кислоты можно рассматривать как производные маннозы.
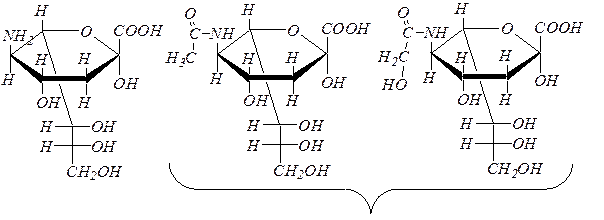
| нейраминовая, или 3,5-дидезокси-5-амино- нонулозоновая, кислота | сиаловые кислоты, или N- ацетил-3,5-дидезокси-5-аминононулозоновая кислота и N- гидроксиацетил-3,5-дидезокси-5-аминононулозоновая кислота. |
Нейраминовая кислота в свободном состоянии содержится в спинномозговой жидкости. Сиаловые кислоты служат компонентами специфических веществ крови и тканей, входят в состав ганглиозидов мозга, участвующих в проведении нервных импульсов.
L-Аскорбиновая кислота (витамин С) – g-лактон 2,3-дегидро- L -гулоновой кислоты.
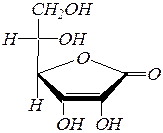
Она содержится во многих фруктах и овощах. Необходима для жизнедеятельности организма человека и животных, катализирует окислительно-восстановительные процессы в организме, например окисление (гидроксилирование) a-аминокислоты пролина.
Применение L- аскорбиновой кислоты в медицинских целях способствует быстрому заживлению ран, срастанию костей, излечению язвы желудка и двенадцатиперстной кишки, а также рекомендуется при тромбофлебите, артеросклерозе, гепатите и т.д.
По структуре аскорбиновая кислота является фиксированным ендиолом, за счёт чего проявляет сильные восстановительные и кислотные свойства (рКа = 4.17).
Промышленное применение нашёл метод синтеза L- аскорбиновой кислоты на использовании доступного сырья (D- глюкозы):
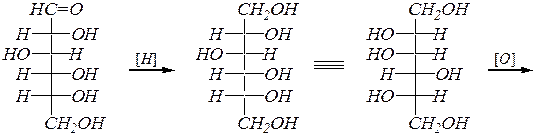
D- глюкоза D- глюцит (L- сорбит)
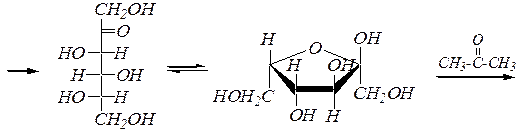
L- сорбоза
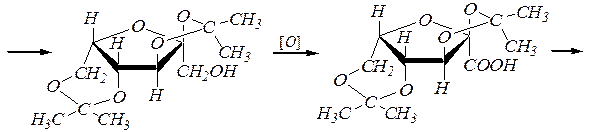
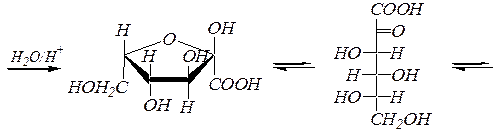
2-оксо- L -гулоновая кислота

g-лактон-2-оксо- L -гулоновой кислоты L- аскорбиновая кислота
(g-лактон-2,3-дегидро- L -гулоновой кислоты)
Кроме чистой L- аскорбиновой кислоты, её соли (аскорбинаты натрия, кальция и железа) и эфиры (пальмитат аскорбиновой кислоты) применяются как в медицинской практике, так и для витаминизации пищевых продуктов.
D-галактуроновая кислота является структурным компонентом пектиновых веществ плодов и ягод. D-глюкуроновая и L-идуроновая кислоты являются структурными единицами гетерополисахарида гепарина.
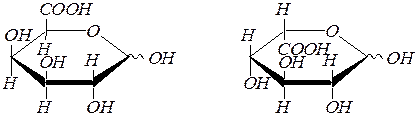
D- галактуроновая кислота L- идуроновая кислота.
Сложные эфиры фосфорной кислоты содержатся во всех растительных и животных организмах. Прежде всего, это a,D-глюкопиранозидофосфат, получающийся при фосфоролизе полисахарида гликогена. Из глюкозы в организме образуется D-глюкозо-6-фосфат, который изомеризуется в D-фруктозо-6-фосфат и затем превращается в D-фруктозо-1,6-дифосфат.
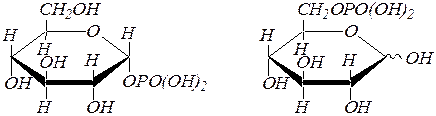
a, D- глюкопиранозидофосфат D- глюкозо-6-фосфат
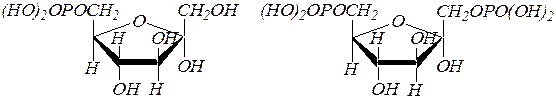
D- фруктозо-6-фосфат a, D- фруктозо-1,6-дифосфат
7.2. олигосахариды
Олигосахариды ¾ это углеводы, молекулы которых состоят из нескольких (от 2 до 10) моносахаридных остатков, соединённых гликозидными связями. По числу таких моносахаридных звеньев, входящих в состав молекулы олигосахарида, выделяют дисахариды (состоящие из двух моносахаридных остатков), трисахариды, тетрасахариды и т.д. Из них дисахариды (или биозы) являются наиболее важными в практическом отношении углеводами и обладают всеми особенностями строения и химического поведения, присущими олигосахаридам в целом.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 8034; Нарушение авторских прав?; Мы поможем в написании вашей работы!