
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость радиоактивного распада. Период полураспада
|
|
|
|
Устойчивые и неустойчивые изотопы
Вопрос № 2. Изотопы. Период полураспада. Использование радиоизотопов (20 мин.)
Изотопы химического элемента имеют одинаковый атомный номер, но различные массовые числа, что обусловлено различным числом нейтронов в ядре.
В Солнечной системе найдены 350 изотопов, которые образованы 90 элементами.
Все изотопы подразделяют на устойчивые и неустойчивые. Устойчивые изотопы не подвергаются радиоактивному распаду. Поэтому они сохраняются в природных условиях. Примерами устойчивых изотопов являются кислород-16 и углерод-12. На Земле существует около 280 устойчивых изотопов. Большинство естественно существующих элементов состоит из одного устойчивого изотопа в смеси с небольшим количеством других устойчивых и неустойчивых изотопов.
Наибольшее число изотопов имеет олово – десять.
Состав природных смесей изотопов одинаков повсюду на Земле. Приводимая в Периодической таблице атомная и молярная массы элемента – это средние массы, зависящие от относительного содержания изотопов.
Установлено, что наибольшей устойчивостью обладают изотопы со следующим числом протонов или нейтронов: 2, 8, 20, 28, 50, 82, 126. Указанные числа получили название магических чисел. Предполагается, что они указывают наличие замкнутых ядерных оболочек, в каком-то смысле аналогичных замкнутым электронным оболочкам атомов благородных газов. Устойчивые изотопы с указанными магическими числами протонов и нейтронов включают 42Не, 168О, 20882 Pb.
Неустойчивые изотопы радиоактивны. Их принято называть радиоактивными изотопами, радиоизотопами или радионуклидами. Радиоизотопы подразделяются на естественные и искусственные. И те, и другие распадаются, испуская при этом a- или b-частицы. Распад продолжается до образования устойчивого изотопа. Известны около 70 естественных радиоизотопов.
|
|
|
Сначала Мария Кюри считала радиоактивность свойством только тяжелых элементов. Действительно, природные радиоизотопы – это изотопы большей частью тяжелых элементов. Например, изотопы всех элементов с атомным номером больше 83 (висмут) радиоактивны. Однако довольно много более легких элементов имеют природные изотопы, например 31 Н, 146С, 4019К, 19078 Pt и др. В принципе возможно получить радиоактивный изотоп любого элемента. Искусственно в лабораториях было получено свыше 1600 изотопов.
Разные изотопы имеют разное время жизни. Скорость распада важно знать, чтобы решить, насколько полезен или опасен данный изотоп.
Скорость, с которой распадается радиоактивный изотоп, нельзя увеличить или уменьшить. Она зависит только от того, какой это изотоп и каково его количество в данный момент времени.
Скорость распада радиоизотопов измеряется периодом полураспада.
Период полураспада t1/2 неустойчивого изотопа – это время, за которое его радиоактивность уменьшается вдвое по сравнению с исходной. Таким образом, промежутки времени, необходимые для того, чтобы из исходного числа радиоактивных атомов N0 осталась половина этого числа N0/2, а также чтобы из N0/2 осталось N0/4, а из N0/4 осталось N0/8 и т.д. равны и составляют t1/2.
Скорость распада пропорциональна числу нераспавшихся радиоактивных атомов.
Периоды полураспада могут составлять от миллионных долей секунды до миллионов лет. Они не зависят от массы радиоактивного вещества, от присутствия катализаторов или изменения температуры.
Периоды полураспада некоторых изотопов
| Изотоп | Символ | Период полураспада | Происхождение |
| Полоний-212 | 21284Ро | 3 × 10-7 с | |
| Углерод-14 | 146С | 5700 лет | Бомбардировка атмосферного азота космическими лучами |
| Уран-238 | 23892U | 4,5 × 109 лет | Урановые минералы |
| Торий-230 | 23090Th | 80000 лет | |
| Радий-226 | 22686Ra | 1620 лет | |
| Цезий-137 | 13755Cs | 27 лет | Выпадение осадков после взрыва атомных и водородных бомб |
| Стронций-90 | 9038Sr | 80000 лет | |
| Радон-222 | 22286Rn | 3,82 дня | Земная кора |
|
|
|
Поскольку скорость распада зависит лишь от первой степени количества N0 радиоактивного вещества, этот процесс относится к реакциям первого порядка и должен описываться кинетическим уравнением
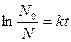 или
или 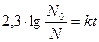 .
.
По истечении периода полураспада количество нераспавшегося радиоактивного вещества должно составлять половину исходного количества, т.е. N0/2, и следовательно, период полураспада можно выразить следующим образом:
t1/2 = 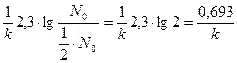 или t1/2 =
или t1/2 = 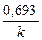 .
.
В общем виде для любого момента времени
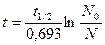 .
.
Величина k (с-1) называется константой скорости радиоактивного распада, характеризует скорость радиоактивного превращения и показывает, какая доля исходного числа атомов радиоактивного изотопа распадается в единицу времени.
Обратная величина 1/k (с) – среднее время жизни радиоактивного элемента – указывает, из какого числа ядер распадается одно ядро в течение 1 с.
Зная период полураспада, нетрудно найти константу скорости радиоактивного распада любого изотопа.
Каждый конкретный изотоп характеризуется индивидуальными значениями постоянных t1/2 и k.
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 901; Нарушение авторских прав?; Мы поможем в написании вашей работы!