
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы получения
|
|
|
|
Ι. Промышленные методы:
1.Фракционная перегонка нефти.
2. Гидрогенизация бурых углей
3. Метод Фишера-Тропша
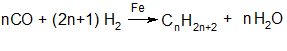
4.Крекинг нефти:

ΙΙ. Лабораторные методы:
1. Сплавление солей карбоновых кислот с щелочами

2. Гидролиз алкилгалогенидов магния

3. Восстановление галогенпроизводных

4. Реакция Вюрца (получение симметричных алканов)

5. Гидрирование алкенов и алкинов (катализаторы – платина, никель,палладий).

6. Получение метана – карбидный метод:

§2.Физические свойства:
Метан (болотный, рудничный газ) – газ, без цвета и без запаха, с воздухом образует взрывоопасную смесь, в воде практически нерастворим.
Алканы С1 – С4 – газы, без цвета, без запаха; С5 – С15 - жидкости, без цвета, имеют слабый характерный «бензиновый» запах; высшие алканы – твердые вещества без запаха. Относительная плотность предельных углеводородов меньше единицы; они практически не растворимы в воде, но растворяются в галогенпроизводных углеводородов, простых и сложных эфирах. Температура кипения линейных алканов выше температуры кипения соответствующих разветвленных изомеров.
Электронное строение:
Атомы углерода находятся в sp³ - гибридном состоянии: в гибридизации участвуют одна s и три р-орбитали с образованием четырех sp3-гибридных орбиталей. Эти орбитали направлены к вершинам тетраэдра под углом 109,5º. Например, строение метана и этана


метан этан
Длина связи С – С в алканах составляет 0,154нм, а длина С – Н – 0,110нм.
Энергия связи С – С – 350 кДж/моль, энергия связи С – Н – 414 кДж/моль.
Молекулы н-алканов с большим числом углеродных атомов имеют зигзагообразное строение, при этом углеродные атомы находятся, с небольшими отклонениями, в одной плоскости:

В углеводородах вокруг связей С – С легко происходит вращение, поэтому существуют различные формы молекулы, отличающиеся расположением атомов в пространстве, т.е. различные конформации. Конформации различаются между собой стабильностью. Наиболее устойчивые конформации, которые фиксируются физико-химическими методами, называются конформерами.
Наиболее стабильными конформациями являются те, в которых межатомное отталкивание наименьшее. Их называют заторможенными конформациями. Конформации, в которых атомы располагаются близко, являются неустойчивыми и называются заслоненными. Различные конформации находятся в динамическом равновесии, и возможность перехода одной заторможенной конформации в другую через заслоненную конформацию, называется барьером вращения. Для изображения конформаций пользуются проекциями Ньюмена (например, конформации этана):

заторможенная заслоненная заторможенная
§3. Химические свойства
Алканы относятся к наиболее инертным в химическом отношении веществам. Причиной этого является высокая прочность σ-связей С – С и С – Н, неполярность связи С – С и низкая полярность связи С – Н. Наиболее характерными для алканов являются реакции радикального замещения. Связь С – С менее прочная, чем связь
С – Н, однако легче протекает замещение атома водорода, т.к. связь С – Н более доступна для атаки реагентом.
Реакции замещения водорода протекают по радикальному механизму и относятся к цепным процессам.
1.Галогенирование алканов. Предельные углеводороды вступают в реакции со всеми галогенами. Со свободным фтором реакция идет со взрывом. Скорость галогенирования снижается в ряду F > Cl > Br > Ι
Непосредственное взаимодействие со F2 дает углерод и НF; свободный фтор вызывает крекинг углеродной цепи, т.к. эта реакция сильно экзотермична
(∆H = - 434,5 кдж/моль). Разбавление фтора азотом или применение растворителей способствует протеканию реакции с высокими выходами полифторпризводных – ценных химически стойких веществ:

Хлор реагирует с алканами только под влиянием света, нагревания или в присутствии катализаторов, причем последовательно замещаются хлором все атомы водорода:

хлористый метил

хлористый метилен

хлороформ

четыреххло-
ристый углерод
Механизм радикального хлорирования метана (Н.Н.Семенов и др.):
Ι. Инициирование цепи

ΙΙ. Рост цепи


·····························································
ΙΙΙ. Обрыв цепи

Обрыв цепи происходит в результате столкновения радикалов со стенками сосуда или в результате тройного столкновения.
При хлорировании наиболее легко замещается водород у наименее гидрогенизированного (третичного) атома углерода.
Фотохимическое бромирование обычно проходит значительно более избирательно, чем хлорирование:
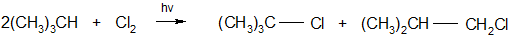
29% 48%

99% 1%
Очень высокая эндотермичность первой стадии роста цепи реакции иодирования алканов (129,8 кДж/моль) делает ее практически неосуществимой даже при температуре порядка 300ºС.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 76; Нарушение авторских прав?; Мы поможем в написании вашей работы!