
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изучение устойчивости гидрозоля гидроксида железа.
|
|
|
|
Цель работы: Синтез гидрозоля гидроксида железа конденсационным методом; определение порога электролитной коагуляции золя и изучение зависимости его от заряда коагулирующего иона; определение защитного числа стабилизатора (высокомолекулярного соединения).
Краткое теоретическое введение.
Гидрозоль гидроксида железа синтезируют методом конденсации путем проведения реакции гидролиза хлорида железа при 100 ºС:
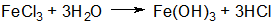
|
Реакция гидролиза FeCl3 идет интенсивно с образованием высокодисперсных нерастворимых в воде частиц Fe (OH)3.
Агрегативная устойчивость золя гидроксида железа обеспечивается, прежде всего, наличием на поверхности дисперсных частиц двойных электрических слоев. Элементарная частица такого золя называется мицеллой. В основе мицеллы лежит нерастворимый в данной дисперсионной среде агрегат, состоящий из множества молекул (атомов): [Fe(OH)3]n, где n – число молекул (атомов), входящих в агрегат.
Поверхность агрегата может заряжаться благодаря избирательной адсорбции ионов из дисперсионной среды или диссоциации молекул в поверхностном слое агрегата. В соответствии с правилом Пескова – Фаянса адсорбируются преимущественно ионы, входящие в состав агрегата, либо специфически взаимодействующие с ним. Ионы, сообщающие агрегату поверхностный заряд, называются потенциалопределяющими. Заряженный агрегат составляет ядро мицеллы.
При данном методе получения золя гидроксида железа ядро [Fe(OH)3]n·m Fe3+ имеет положительный поверхностный заряд за счет адсорбции ионов Fe3+ из среды (m – число адсорбированных ионов).Заряд ядра компенсируется эквивалентным зарядом противоположно заряженных ионов – противоионов, расположенных в объеме среды.
Противоионы, находящиеся непосредственно у поверхности ядра (на расстояниях, близких к диаметрам ионов), помимо электростатических сил испытывают силы адсорбционного притяжения поверхности. Поэтому они особо прочно связаны с ядром мицеллы и носят название противоионов адсорбционного слоя (их число m - x). Остальные противоионы составляют диффузно построенную ионную оболочку и называются противоионами диффузного слоя (их число соответствует х).
Мицелла гидрофобного золя является электронейтральной. Формулу мицеллы ионостабилизированного золя гидроксида железа можно записать следующим образом:

агрегат потенциал- противоионы ионы диффузного
определяющие плотного слоя
ионы слоя
_______________________
ядро мицеллы
_________________________________________
коллоидная частица
______________________________________________________
Мицелла
В формуле мицеллы границы коллоидной частицы обозначены фигурными скобками. Толщина адсорбционного слоя δ мала (< 1 нм) и постоянна. Толщина диффузного слоя λ существенно больше (может быть > 10 нм) и сильно зависит от концентрации электролитов в системе.
По теории Гуи-Чепмена противоионы диффузной части ДЭС распределяются в поле поверхностного потенциала в соответствии с законом Больцмана. Теория показывает, что потенциал в диффузной части слоя снижается с расстоянием по экспоненте. При малом значении потенциала эта зависимость выражается уравнением
φ = φδе – אх (1)
где φδ – потенциал диффузного слоя; х – расстояние от начала диффузной части ДЭС; א – величина, обратная толщине диффузной части слоя.
За толщину диффузной части слоя принято расстояние, на котором потенциал диффузной части слоя φδ уменьшается в е раз.
В соответствии с той же теорией толщина диффузной части слоя равна:
 (2)
(2)
где ε0- электрическая постоянная; ε- относительная диэлектрическая проницаемость среды; F – постоянная Фарадея; I – ионная сила раствора;
С0i – концентрация иона в растворе; zi – заряд иона электролита.
Из уравнения следует, что λ уменьшается с ростом концентрации электролита, заряд его ионов и с понижением температуры.
При движении одной фазы относительно другой на плоскости скольжения происходит разрыв ДЭС (как правило, в диффузной части) и возникновение электрокинетического («дзета») ζ – потенциала (см. рис 1).
В процессе коагуляции высокодисперсного слоя гидроксида железа образуются сравнительно небольшие по размерам седиментационно-устойчивые агрегата. Поэтому исследование коагуляции частиц Fe(OH)3 удобнее всего проводить с помощью турбидиметрического метода. Применимость этого метода основывается на сильной зависимости интенсивности светорассеяния от размеров частиц. При коагуляции частиц она повышается, соответственно увеличивается оптическая плотность золя. Поскольку при прохождении светового потока через окрашенные золи часть света рассеивается, а часть поглощается, то при изучении коагуляции в таких системах методом турбидиметрия необходимо исключить поглощение света. Для золя Fe (OH)3 этого можно достичь, проводя измерения при красном светофильтре, т.е. при длине волны падающего света λ = 620 – 625нм.
Порог быстрой коагуляции находят по пороговому объему электролита
Vк (мл), при котором оптическая плотность золя достигает максимального значения, а при дальнейшем добавлении электролита не изменяется. Значение ск рассчитывают по формуле:
 (3)
(3)
где ск – концентрация введенного электролита, моль/л; V – объем золя, мл.
Для предотвращения агрегации частиц и защита гидрозолей от коагулирующего действия электролитов применяют высокомолекулярные соединения и коллоидные ПАВ, растворимые в воде, например белки, мыла, крахмал, декстрин. Их стабилизирующее действие основано на образовании на поверхности частиц дисперсной фазы адсорбционных гелеобразных пленок и связано как с уменьшением межфазного натяжения. Так и со структурно – механическими свойствами поверхностных слоев.
Защитная способность полимеров или ПАВ относительно выбранного золя характеризуется защитным числом S – количеством вещества, требуемого для стабилизации единицы объема золя. Защитное число S, как и порог коагуляции ск, определяют методом турбидиметрии. Защитное число S(г/л золя) вычисляют по уравнению:
 (4)
(4)
где сст – концентрация раствора стабилизатора, г/л; Vзащ – объем раствора стабилизатора, необходимый для предотвращения коагуляции золя, мл.
При коагуляции электролитами по концентрационному механизму (для сильно заряженных частиц) порог коагуляции ск обратно пропорционален заряду z коагулирующего иона в шестой степени, т.е
 (5)
(5)

Рис 2. Зависимость оптической плотности D золя от объема электролита – коагулятора Vэл.
Рис 3. Зависимость оптической плотности D золя от объема раствора стабилизатора Vст.
Значение Vзащ соответствует объему стабилизатора в золе, содержащем пороговый объем Vк электролита, при котором на кривой зависимости
D = f (Vст) появляется нижний горизонтальный участок (рис. 3).
Приборы и методы измерений
Фотоэлектроколориметр типа ФЭК – 56М.
Электрическая плитка.
Коническая колба емкостью 250 мл.
Пробирки емкостью 20 мл.
Бюретки емкостью 25 мл и градуированные пипетки.
2 %-ый (масс.) раствор сульфата натрия.
0,5М раствор ацетата натрия.
0,01 %-ый (масс.) раствор желатина.
Последовательность выполнения работы.
Для получения гидрозоля Fe (OH)3 в колбу с 250 мл кипящей дистиллированной воды наливают 10 мл раствора хлорида железа. Образовавшийся золь, красно – коричневого цвета, охлаждают до комнатной температуры.
Далее исследуют коагуляцию золя гидроксида железа при введении в него растворов сульфата натрия или ацетата натрия путем измерения оптической плотности полученных систем.
В 10 пробирок наливают по 10 мл золя, воду и электролит (раствор Na2SO4 или СН3СООNa) в следующих объемах:
Номер пробирки … 1 2 3 4 5 6 7 8 9 10
Объем воды мл …...10,0 9,0 8,5 8,0 7,5 7,0 6,5 6,0 5,5 5,0
Объем электролита
Vэл мл ……………. 0 1,0 1,5 2,0 2,5 3,0 3,5 4,0 4,5 5,0
Таблица 1. Результаты исследования коагуляции золя гидроксида железа оптическим методом.
| Объем электролита Vэл ,мл | Оптическая плотность золя D |
| электролит NaCH3COO | электролит Na2SO4 |
Электролит вводят в каждую пробу золя за 2-4 мин непосредственно перед измерением ее оптической плотности.
Измеряют оптическую плотность золя в каждой колбе с помощью фотоэлектроколориметра с применением светофильтра № 8 или № 9.
Последовательность выполнения работы.
Полученные данные записывают в таблицу (см. табл. 1).
Строят график зависимости D =f(Vэл) для Na2SO4 и CH3COONa, по нему находят пороговые объемы электролита Vк, вызывающие быструю коагуляцию золя, и по формуле рассчитывают значения ск. Сравнивают найденные значения ск для Na2SO4 и CH3COONa и объясняют их в соответствии с правилом Шульце – Гарди [ законом Дерягина – Ландау, см. уравнение (5)].
Затем определяют защитное число полиметра – желатина относительно золя Fe(OH)3. Для этого готовят 10 проб, наливая в пробирки золь и растворы в следующем объеме и последовательности:
Номер пробирки …. 1 2 3 4 5 6 7 8 9 10
Объем золя, мл ….. 10 10 10 10 10 10 10 10 10 10
Объем воды, мл …. До 20 мл, учитывая объемы золя, раствора желатина
и электролита
Объем раствора
желатины Vст, мл …. 5,0 4.0 3,5 3,0 2,5 2,0 1,5 1,0 0.5 0
Объем электролита, мл в объеме, соответствующем Vк
Как и при исследовании коагуляции, общий объем проб должен быть одинаковым и составлять 20 мл. Электролит – коагулятор добавляют через 10-15 мин после введения желатины (для адсорбции желатины на частицах золя). Оптическую плотность золя измеряют через 3-5 мин после введения электролита. Значения D записывают в таблицу (см. табл. 2).
Строят график зависимости D = f(Vст). Находят объем раствора желатина Vзащ, необходимый для предотвращения коагуляции золя, и по формуле (4) рассчитывают защитное число S.
Таблица 2. Экспериментальные данные для определения
защитного числа желатины.
| № пробирки | Объем раствора желатина Vст,мл | Оптическая плотность золя D |
Контрольные вопросы.
1.Строение двойного электрического слоя коллоидных наночастиц.
2. Факторы, обеспечивающие агрегативную устойчивость наночастиц.
3. Концентрационная и нейтрализационная коагуляция золей под действием электролитов.
4. Правило Шульце-Гарди и закон шестой степени Дерягина-Ландау.
5.Основные положения теории ДЛФО.
6. Влияние электролитов на поверхностные силы и устойчивость наносистем.
7. Адсорбционно-сольватный и структурно-механический факторы устойчивости наносистем.
8. Коллоидная защита. Защитное число стабилизатора.
Литература.
1.Фролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. Учебник для вузов.-М.:Химия, 1988.
2. Зимон А.Д. Коллоидная химия. М.: Агар, 2007.
3. Лабораторные работы и задачи по коллоидной химии.-Под ред. Ю.Г.Фролова и А.С.Гродского._М.:Химия,1986.
ЛАБОРАТОРНАЯ РАБОТА № 5
«Изучение свойств коллоидных дисперсных систем методом капиллярного электрофореза»
Цель работы: Определение электрофоретической подвижности наночастиц дисперсных систем методом электрофореза.
Краткое теоретическое введение.
Все электрические свойства межфазных поверхностей и явления, протекающие на них, обусловлены наличием двойного электрического слоя на границе раздела фаз. Количественные связи между параметрами двойного электрического слоя определяются его строением. На границе соприкасающихся фаз заряды располагаются в виде двух разноименных ионов: ряд потенциалопределяющих ионов на расстоянии, равном их радиусу в несольватированном состоянии, и прилегающий к нему ряд противоионов. Слой противоионов состоит из двух частей. Одна часть примыкает непосредственно в межфазной поверхности и образует адсорбционный слой (слой Гельмгольца) толщиной δ, которая равна радиусу гидратированных ионов его составляющих.
Другая часть противоионов находится в диффузной части – диффузном слое (слой Гуи) толщиной λ, которая может быть значительной и зависит от свойств и состава системы.
Сказанное иллюстрируется на рис. 1, на котором схематически изображено строение мицеллы золя с отрицательно заряженными коллоидными частицами (потенциалопределяющие ионы обозначены знаком «-», противоионные – знаком «+»).
Рассмотрим строение мицеллы золя. В центре мицеллы находится кристаллическое тело, названное по предложению Пескова, агрегатом. На нем, согласно правилу Панета – Фаянса, адсорбируются ионы, способные достраивать его кристаллическую решетку. Эти ионы сообщают агрегату электрический заряд и называются потенциалопределяющими. В результате образуется ядро мицеллы, несущее электрический заряд, равный сумме электрических зарядов, адсорбировавшихся на агрегате потенциалопределяющих ионов. Ядро создает вокруг себя электрическое поле, под действием которого к нему из раствора притягиваются противоионы. Часть этих противоионов прочно связаны с ядром мицеллы за счет адсорбционных и электростатических сил и образует слой противоионов адсорбционного слоя.
Другая часть противоионов образует диффузный слой противоионов, удерживаемых около ядра только электростатическими силами. Ядро мицеллы вместе с адсорбционным слоем противоионов называется коллоидной частицей (гранулой).

|
Рис. 1 – строение мицеллы (а) и двойного электрического слоя (б).
Частица (гранула) вместе с диффузным слоем противоионов образует мицеллу. В целом мицелла электронейтральна.
На границе между ядром и всеми противоионами возникает термодинамический потенциал, а на границе между частицей (гранулой) и диффузным слоем (плоскостью скольжения)возникает электрокинетический потенциал – дзета – потенциал.
При наложении на дисперсную систему внешней разности потенциалов происходит разрыв двойного электрического слоя по плоскости скольжения, в результате чего частица получает определенный заряд и перемещается к соответствующему электроду, а противоионы диффузного слоя – к другому.
Направленное движение частиц дисперсной фазы под действием приложенной разности потенциалов называется электрофорезом.
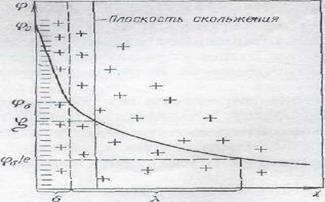
Скорость электрофореза зависит от дзета - потенциала (электрокинетического потенциала), величина которого определяется по уравнению Гельмгольца – Смолуховского (если радиус частиц много больше толщины двойного электрического слоя):
 , где (1)
, где (1)
 - вязкость;
- вязкость;  - относительная диэлектрическая проницаемость среды;
- относительная диэлектрическая проницаемость среды;  = 8,85 ∙10-12
= 8,85 ∙10-12  - диэлектрическая проницаемость вакуума; u - электрофоретическая подвижность частиц.
- диэлектрическая проницаемость вакуума; u - электрофоретическая подвижность частиц.
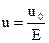 , где (2)
, где (2)
u0 - скорость движения дисперсной среды, Е – градиент потенциала электрического поля.
 , где (3)
, где (3)
U – внешний потенциал на электродах; L – расстояние между электродами.
Для определения скорости электрофореза используют следующие методы:
1) микроскопический – заключается в непосредственном определении скорости движения частицы под ультрамикроскопом.
2) макроскопический или метод передвигающейся границы.
В последние два десятилетия в мире отмечен активный интерес к новому интенсивно развивающемуся методу – капиллярному электрофорезу, позволяющему анализировать ионные и нейтральные компоненты различной природы с высокой экспрессностью и эффективностью.
В основе капиллярного электрофореза лежат электрокинетические явления – электромиграция ионов и других заряженных частиц и электроосмос. Эти явления возникают в растворах при помещении их в электрическое поле высокого напряжения.

|
Рис 2. Устройство системы капиллярного электрофореза
Если раствор находится в тонком капилляре, например, в кварцевом, то электрическое поле, наложенное вдоль капилляров, вызывает в нем движение заряженных частиц и пассивный поток жидкости, в результате чего проба разделяется на индивидуальные компоненты, так как параметры электромиграции специфичны для каждого вида частиц. В тоже время такие возмущающие факторы, как диффузионные, сорбционные, конвекционные, гравитационные в капилляре существенно ослаблены, благодаря чему достигаются высокие эффективности разделения смеси. Минимальный состав системы, реализующей метод капиллярного электрофореза, должен включать следующие узлы: кварцевый капилляр, источник высокого напряжения, устройство ввода пробы, детектор, систему сбора, обработки и вывода информации (рис.2).
Приборы и методы измерений
Для выполнения работы требуется: система капиллярного электрофореза «КАПЕЛЬ – 103Р» с положительной полярностью высокого напряжения, весы лабораторные типа ВЛР – 200, мерные колбы, пипетки, дозаторы пипеточные, рН - метр лабораторный, стаканы химические, баня водяная.
Реактивы: Нитрат серебра х.ч., боргидрид натрия х.ч., желатин марки «фото А», гидроксид натрия, дистиллированная вода.
Методика измерения
Метод капиллярного электрофореза основан на разделении заряженных компонентов сложной смеси в кварцевом капилляре под действием приложенного электрического поля. Микрообъем анализируемого раствора вводят в кварцевый капилляр, предварительно заполненный подходящим буфером-электролитом. После подачи высокого напряжения (до 30кВ) к концам капилляра компоненты смеси начинают двигаться по капилляру с разной скоростью, зависящей от их структуры, заряда и молекулярной массы и, соответственно, в разное время достигают зоны детектирования.
Идентификацию и количественное определение анализируемых компонентов проводят косвенным методом, регистрируя поглощение в ультрафиолетовой области спектра.
Полученная последовательность пиков называется электрофореграммой (рис.3), качественной характеристикой вещества является время миграции, а количественной – высота или площадь пика, пропорциональная концентрация вещества.

Рис 3. Электрофореграмма.
(Модельный раствор)
Схема экспериментальной установки
Используемая в данной работе система капиллярного электрофореза «КАПЕЛЬ-103 Р» (рис 4) оснащена фотометрическим детектором и микролинзовой фокусирующей системой. Источник света – ртутная лампа низкого давления с ВЧ- возбуждением, обеспечивающая высокую степень светового потока. В качестве приемника применяется карбид кремневый фотодиод, чувствительный спектра 200-310 нм, в которой присутствует единственная линия ртути 253,7 нм. Этими свойствами обусловлены высокая чувствительность системы, монохроматические условия регистрации и широкий линейный диапазон определяемых концентраций.

Рис 4. Система капиллярного электрофореза «КАПЕЛЬ – 103Р»
Последовательность выполнения работы
1) получение золя частиц серебра.
Золь частиц серебра получают реакцией восстановления. К 50мл раствора AgNO3 с концентрацией 2·10-4 моль/л добавляем при перешивании раствор NaBH4 с концентрацией 2·10-4 моль/л с объемной скоростью 5мл/мин. Исходные растворы солей содержат 0,1% желатина (кислотного).
2) подготовка капилляра к работе.
3) приготовление вспомогательных и градуировочных растворов.
4) градуировка системы капиллярного электрофореза «КАПЕЛЬ».
Градуировку системы осуществляют путем измерения сигналов градуировочных растворов. Контроль стабильности градировочной характеристики проводится непосредственно перед измерениями анализируемых образцов путем записи электрофореграмм одной из градуировочных смесей.
5) выполнение измерений.
Обработка результатов измерений
На основании полученных с помощью программного продукта «МУЛЬТИХРОМ для WINDOWS» данных проводят расчет электрофоретической подвижности по формуле.
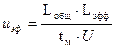 (4)
(4)
где Lобщ – общая длина капилляра, Lэфф – эффективная длина капилляра, U – приложенная разность потенциалов, tм – время миграции (время, необходимое компоненту для прохождения им эффективной длины капилляра от зоны ввода пробы до зоны детектирования).
Непосредственно из электрофореграммы нельзя определить электрофоретическую подвижность поскольку время миграции частицы tм в этом случае равно сумме времен миграции самой частицы и маркера. Из эксперимента можно найти так называемою общую подвижность, которая выражается по формуле uобщ = uмарк + uэф. Зная из эксперимента uобщ и uмарк можно легко рассчитать uэф.
Контрольные вопросы.
1. Каково строение двойного электрического слоя?
2. Что такое электрокинетический потенциал и как его можно определить?
3. Что такое электрофорез? Как количественно можно охарактеризовать это
явление?
4. Капиллярный электрофорез. Основы метода и его практическое
применение?
Литература
1. Зимон А.Д., Лещенко Н.Ф. Коллоидная химия. Поверхностные явления и дисперсные системы. М: Химия, 1995 (и более поздние издания).
2. Воюцкий С.С. Курс коллоидной химии. М: Высшая школа, 1975.
3. Фролов Ю.Г., Гродский А.С. Лабораторные работы и задачи по коллоидной химии. М: Химия, 1986
4. Панич Р.М., Воюцкий С.С. Практикум по коллоидной химии и электронной микроскопии. М: Химия, 1974
5. Комарова Н.В., Каменцев Я.С. Практическое руководство по использованию систем капиллярного электрофореза «КАПЕЛЬ». С-ПЕТЕРБУРГ: ВЕДА, 2006.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 225; Нарушение авторских прав?; Мы поможем в написании вашей работы!