
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перший закон термодинаміки
|
|
|
|
В стані термодинамічної рівноваги всі параметри системи не змінюються з часом, а тиск і температура є однаковими в усіх частинах системи. При цьому термодинамічні параметри зв’язані між собою рівнянням, яке називається рівнянням стану. Рівняння стану ідеального газу – це рівняння Менделеєва-Клапейрона.
Термодинаміка вивчає найбільш загальні макроскопічні властивості тіл, що проявляються при перетвореннях одних видів енергії в інші. Надалі тіло чи систему тіл будемо називати термодинамічною системою.
Основні поняття термодинаміки
Розділ 7. ТЕРМОДИНАМІКА
Стан термодинамічної системи задається з допомогою таких величин, як:
· р – тиск
· V – об’єм
· Т – температура
Ці величини називаються термодинамічними параметрами.
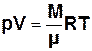 , (7.1)
, (7.1)
де M – маса газу, μ – молярна маса,
R = 8,31 Дж/(моль К) – універсальна газова стала.
Важливим поняттям термодинаміки є поняття внутрішньої енерґії. Внутрішня енерґія U ідеального газу складається лише з середньої кінетичної енерґії молекул газу і залежить від температури газу:
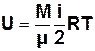 , (7.2)
, (7.2)
де і – число ступенів вільності молекули.
Для реальних газів внутрішня енерґія залежить і від інших термодинамічних параметрів. Внутрішня енерґія є функцією стану системи: кожному стану системи відповідає певне значення внутрішньої енерґії. При переході системи зі стану 1 в стан 2 зміна внутрішньої енергії дорівнює:
 U = U2 - U1. (7.2а)
U = U2 - U1. (7.2а)
Якщо після проходження проміжних станів система повертається у початковий стан, то:  U = 0. (7.2б)
U = 0. (7.2б)
Обмін енерґією між термодинамічною системою і зовнішніми тілами може відбуватися двома способами:
· шляхом теплообміну (системі передається кількість теплоти Q)
· шляхом виконання роботи.
Формулювання першого закону термодинаміки:
Кількість теплоти Q, яка надається системі, витрачається на збільшення внутрішньої енерґії системи ΔU і на виконання роботи А проти зовнішніх сил.
Q =  U + A. (7.3)
U + A. (7.3)
Звичайно цей закон записують для безмежно малих величин:
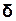 Q = dU +
Q = dU + 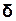 A. (7.4)
A. (7.4)
Відмінність у позначеннях величин пов’язана з тим, що dU означає зміну внутрішньої енергії, а 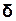 А і
А і 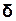 Q -лише безмежно малі величини.
Q -лише безмежно малі величини.
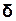 A = pdV. (7.5)
A = pdV. (7.5)
Перший закон термодинаміки запишемо у вигляді:
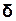 Q = dU + pdV. (7.6)
Q = dU + pdV. (7.6)
Застосуємо перший закон термодинаміки до ізопроцесів в ідеальних газах:
· ізохорний процес (М,V = const) 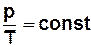
Якщо V = const, то dV = 0, отже 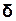 A = 0. Тому:
A = 0. Тому:
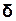 Q = dU. (7.7)
Q = dU. (7.7)
При ізохорному процесі вся теплота, надана системі, йде на збільшення внутрішньої енерґії системи.
· ізотермічний процес (М, T = const) pV = const
Якщо T = const, то з (7.2) U = const і dU = 0 отже:
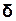 Q =
Q = 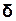 A. (7.8)
A. (7.8)
При ізотермічному процесі вся теплота, надана системі, йде на виконання системою роботи проти зовнішніх сил. Якщо об’єм системи змінюється від V1 до V2, то виконана системою робота описується формулою:
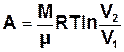 . (7.9)
. (7.9)
Якщо система розширюється (V2>V1), то А>0;
при стиску системи (V2<V1) A<0.
· ізобарний процес (М, p = const) 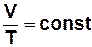
Формулювання першого закону термодинаміки для ізобарного процесу співпадає із загальним формулюванням. Робота, виконана при ізобарному розширенні системи від об’єму V1 до об’єму V2,
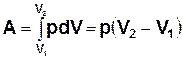 . (7.10)
. (7.10)
При стиску системи (V2<V1) A<0.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 61; Нарушение авторских прав?; Мы поможем в написании вашей работы!