
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 3. Расчет характеристических термодинамических функций
|
|
|
|
Задача №9
Определите абсолютную энтропию ST 1 моль вещества, указанного в таблице 10, при температуре Т К (табл. 6), если известны значения температур плавления и кипения этого вещества. Теплоемкости веществ в различных агрегатных состояниях возьмите из справочника.
Теплоту испарения возьмите из расчетов задачи №5.
Таблица 10
| Вариант | Вещество | ТПЛ, К | ТКИП, К |
 нитрометан нитрометан
| |||
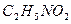 нитроэтан нитроэтан
| |||
 этиленгликоль этиленгликоль
| |||
 глицерин глицерин
| |||
 диметиламин диметиламин
| |||
 ацетон ацетон
| |||
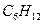 циклогексан циклогексан
| |||
 этилацетат этилацетат
| |||
 пропанол-1 пропанол-1
| |||
 этанол этанол
| |||
 амиловый спирт амиловый спирт
| |||
 муравьиная кислота муравьиная кислота
| |||
 хлороформ хлороформ
| |||
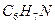 анилин анилин
| |||
 диэтиловый эфир диэтиловый эфир
| |||
 пиридин пиридин
|
Продолжение таблицы 10
| Вариант | Вещество | ТПЛ, К | ТКИП, К |
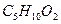 валериановая кислота валериановая кислота
| |||
 толуол толуол
| |||
 октан октан
| |||
 муравьиная кислота муравьиная кислота
| |||
 бутанол бутанол
| |||
 хлорметан хлорметан
| |||
 пентан пентан
| |||
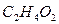 уксусная кислота уксусная кислота
| |||
 нитробензол нитробензол
| |||
 хлорбензол хлорбензол
| |||
 м-ксилол м-ксилол
| |||
 нитроглицерин нитроглицерин
| |||
 1,4-диоксан 1,4-диоксан
| |||
 бензол бензол
|
Решение:
Определим абсолютную энтропию 1 моль воды при температуре минус 700 С.
Абсолютное значение энтропиипозволяет определить третье начало термодинамики или теорема Нернста: при абсолютном нуле энтропия правильного кристалла любого чистого вещества равна нулю (эту формулировку теоремы Нернста предложил М.Планк).
S0 = 0 при Т = 0.
Абсолютную энтропию вещества при температуре Т рассчитывают, используя постулат Планка, а также значения теплоемкостей, температур фазовых переходов и теплот фазовых переходов в интервале от 0 К до Т. На практике для расчета абсолютной энтропии при температуре Т используют справочные данные об абсолютных энтропиях веществ при 298 К. При расчете вносится поправка, учитывающая изменение энтропии вещества в интервале от 298 К до Т.
|
|
|
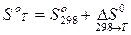 .
.
По условию задачи необходимо определить энтропию при температуре минус 700 С, т.е. при 203 К, следовательно, к значению  необходимо прибавить изменение энтропии в интервале температур от 298 до 203 К.
необходимо прибавить изменение энтропии в интервале температур от 298 до 203 К.
В заданном интервале температур вода претерпевает фазовое превращение – плавление при 273 К. Расчет энтропии проводится по аддитивной схеме:
 . (31)
. (31)
В справочнике найдем абсолютную энтропию воды при 298 К.
 = 69,95 Дж/(моль∙К).
= 69,95 Дж/(моль∙К).
Изменение энтропии при нагревании и плавлении определим по формулам:
 , (32)
, (32)
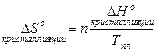 , (33)
, (33)
 , (34)
, (34)
где n – число молей вещества; по условию задачи n = 1.
Теплоту кристаллизации воды найдем по справочнику:
DHоплавления = 6000 Дж/моль. DHокрист. = - DHоплавления = -6000 Дж/моль.
Примечание: теплоту плавления для органических веществ рассчитайте по формуле  = 54,4 ± 12,6 Дж/(моль·К).
= 54,4 ± 12,6 Дж/(моль·К).
 -21,98 Дж/К.
-21,98 Дж/К.
Изменение температуры жидкости равно 25 градусов. Температурный интервал невелик, и можно пренебречь зависимостью теплоемкости жидкой воды от температуры. Для расчетов воспользуемся средним значением теплоемкости; по справочнику
 = 75,3 Дж/(моль∙К).
= 75,3 Дж/(моль∙К).
Расчет в этом случае проведем по формуле:
 = -6,59 Дж/К.
= -6,59 Дж/К.
Для льда разность температур составляет 70 градусов. Учтем зависимость теплоемкости от температуры (коэффициенты уравнения возьмем из справочника):
 = 4,41 + 109,5·10–3 Т + 46,47·10–6 Т2 Дж/(моль∙К).
= 4,41 + 109,5·10–3 Т + 46,47·10–6 Т2 Дж/(моль∙К).
 =
=
= 

Рассчитаем абсолютную энтропию воды при –700 С (31):
 = 69,95 – 21,98 – 6,59 – 9,75 = 31,63 Дж/К.
= 69,95 – 21,98 – 6,59 – 9,75 = 31,63 Дж/К.
|
|
|
Задача №10
Вычислите изменение энтропии в реакции, приведенной в табл. 2, при температуре T = 298 К и Т К (табл. 6).
Решение:
Определим изменение энтропии реакции  при температурах 298 К и 800 К.
при температурах 298 К и 800 К.
Выписываем из справочника абсолютные энтропии участников реакции:
Таблица 11
| Вещество | S0298 , Дж/(моль·К) |
| N2 | 191,50 |
| H2 | 130,52 |
| NH3 | 192,66 |
 прод прод
| 385,32 |
 исх исх
| 583,06 |
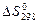 , реакции , реакции
| – 197,74 |
Изменение энтропии 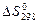 в ходе реакции при температуре 298 К равно разности абсолютных энтропий продуктов и исходных веществ, взятых с учетом стехиометрических коэффициентов:
в ходе реакции при температуре 298 К равно разности абсолютных энтропий продуктов и исходных веществ, взятых с учетом стехиометрических коэффициентов:
 . (35)
. (35)
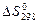 = 2·192,66 –191,50 –3·130,52 =385,32 –583,06= –197,74 Дж/К.
= 2·192,66 –191,50 –3·130,52 =385,32 –583,06= –197,74 Дж/К.
Изменение энтропии реакции при температуре Т рассчитывается по общей формуле:
 . (36)
. (36)
Для приближенного расчета можно пренебречь зависимостью теплоемкостей от температуры и воспользоваться значениями средних теплоемкостей участников реакции. В этом случае расчет ведется по формуле
 . (37)
. (37)
Для точного расчета необходимы данные по зависимости теплоемкостей от температуры. В этом случае изменение энтропии реакции рассчитывается по формуле:
 (38)
(38)
Воспользуемся справочными данными и результатами расчетов из задачи №8.
Приближенно:
 , реакции= – 197,74 + (– 31,88) ln (800/298) = – 229,22 Дж/K.
, реакции= – 197,74 + (– 31,88) ln (800/298) = – 229,22 Дж/K.
Точно:
 , реакции= – 197,74 + (–50,12) ln(800/298) + 36,91·10–3(800 – 298) +
, реакции= – 197,74 + (–50,12) ln(800/298) + 36,91·10–3(800 – 298) +
+ 1/2(–1,50·10–6)(8002 – 2982) – 1/2(–3,34·105)(1/8002 – 1/2982) =
= – 230,36 Дж/K.
Задача №11
Рассчитайте изменение энтропии при смешении n1 моль газа 1 и n2 моль газа 2 при постоянной температуре и давлении 1 атм (табл. 12). Принять, что данные вещества подчиняются законам идеальных газов.
Таблица 12
| Вариант | Газ 1 | Газ 2 | n1, моль | n2 , моль |
| H2 | N2 | |||
| H2O | O2 | |||
| He | CO2 | |||
| CH4 | C2H6 | |||
| Ne | CH4 | 2,5 | ||
| H2 | He | |||
| CO | C2H4 | 3,5 | ||
| CO2 | N2 | |||
| CH4 | CO2 | |||
| C2H6 | Xe | |||
| CH4 | C2H4 | |||
| CO | CO2 | |||
| N2 | Cl2 | |||
| H2O | N2 | |||
| He | O2 | |||
| N2 | O2 | |||
| F2 | Ar | |||
| Ne | Cl2 | |||
| Kr | CO2 | |||
| Ar | Cl2 | |||
| O2 | H2 | |||
| Cl2 | N2 | |||
| CO | Kr | 1,5 | ||
| Ar | Ne | 4,5 | ||
| Xe | F2 | 2,5 | ||
| C2H4 | Kr | 3,5 | 4,5 | |
| CO2 | F2 | 1,8 | ||
| C2H4 | Ne | 7,5 | ||
| CH4 | Ar | 4,5 | ||
| Kr | Cl2 | 8,5 |
Решение:
|
|
|
Рассчитаем изменение энтропии при смешении двух молей азота (газ 1) и трех молей водорода (газ 2) при постоянной температуре и давлении 1 атм.
В случае смешения идеальных газов процесс можно представлять как изотермическое расширение каждого из газов до общего объема. При изотермическом расширении
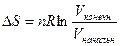 , (39)
, (39)
где n – число молей газа, Vначальн – начальный объем газа, Vконечн – конечный объем, который в данном случае (при р = const) равен сумме начальных объемов обоих газов.
Для газа 1
 ,
,
так же можно выразить DS2. Следовательно,
DSсмеш = DS1 + DS2 =  . (40)
. (40)
Парциальный объем идеального газа пропорционален его мольной доле в смеси. Мольная доля газа в смеси рассчитывается по формуле:
 . (41)
. (41)
Выразим мольную долю газа 1 в смеси
 ,
,
и газа 2 –
 ,
,
Тогда изменение энтропии при смешении двух газов можно рассчитать по формуле
DSсмеш = –R ( ) (42)
) (42)
DSсмеш = –8,314( ) = 27,98 Дж/К.
) = 27,98 Дж/К.
Так как ∆S>0 процесс смешения газов протекает самопроизвольно.
Задача №12
В изолированной системе при Т = 298 К 1 моль идеального газа обратимо изотермически сжимается от давления p1= 1,0133·105 Па до p2 (табл. 13). Вычислить значения работы расширения А, теплоты Q, изменения внутренней энергии DU, энтальпии DH, энтропии DS, энергии Гиббса DG и энергии Гельмгольца DF системы. Определить направление самопроизвольного процесса.
Таблица 13
| Вариант | p2∙ 10–5, Па | Вариант | p2∙ 10–5, Па | Вариант | p2∙ 10–5, Па |
| 1,019 | 1,925 | 4,035 | |||
| 1,722 | 2,064 | 6,900 | |||
| 1,317 | 8,100 | 4,125 | |||
| 3,039 | 5,066 | 1,310 | |||
| 1,823 | 1,330 | 1,423 | |||
| 1,519 | 1,365 | 1,805 | |||
| 1,215 | 1,578 | 2,148 | |||
| 4,053 | 3,520 | 1,516 | |||
| 2,533 | 2,345 | 2,045 | |||
| 5,066 | 3,543 | 1,790 |
Решение:
Определим изменение характеристических термодинамических функций при обратимом изотермическом сжатии 1 моль идеального газа от p1= 1,0133·105 Па до p2= 1,0133·106 Па.
При изотермическом сжатии идеального газа изменение внутренней энергии ∆U = 0 и изменение энтальпии ∆H = 0. Поэтому из формулы (5)
|
|
|
 .
.
Работа изотермического сжатия от p1 до p2 определяется по формуле:
 . (43)
. (43)
A = Q = 1∙8,314∙298∙ln(1,0133·105/1,0133·106 ) = – 5698,42 Дж.
Изменение энтропии в изотермическом процессе определяется по формуле
 . (44)
. (44)
 1∙8,314 ∙ln(1,0133·105 /1,0133·106 ) = – 19,12 Дж/К.
1∙8,314 ∙ln(1,0133·105 /1,0133·106 ) = – 19,12 Дж/К.
Изменение состояния системы выражается через изменение энергии Гельмгольца ∆F и изменение энергии Гиббса ∆G:
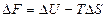 (V = const, T = const); (45);
(V = const, T = const); (45);
 (p = const, T = const); (46).
(p = const, T = const); (46).
∆F = 0 – 298 ∙(–19,12) = 5697,76 Дж.
∆G = 0 – 298 ∙(–19,12) = 5697,76 Дж.
Так как процесс протекает в изолированной системе, критерием направленности самопроизвольного процесса является изменение энтропии. Если ∆S > 0, процесс самопроизвольно идет в прямом направлении. По расчету ∆S < 0, следовательно, процесс идет самопроизвольно в обратном направлении.
Задача №13
Определите, осуществима ли при постоянном давлении 1 атм и температуре Т = 298 К реакция, приведенная в табл. 2.
Решение:
Определим, осуществима ли при постоянном давлении 1 атм и температуре Т = 298 К реакция 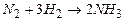 .
.
В изобарно-изотермических условиях (p = const, T = const) на вопрос о возможности протекания самопроизвольного процесса отвечает функция Гиббса. Если изменение энергии Гиббса для реакции меньше нуля ( < 0) – реакция самопроизвольно протекает в прямом направлении, если больше нуля (
< 0) – реакция самопроизвольно протекает в прямом направлении, если больше нуля ( > 0) – в обратном направлении.
> 0) – в обратном направлении.
Вариант а) Определить  при 298 К можно непосредственно по справочным данным о значениях
при 298 К можно непосредственно по справочным данным о значениях  всех участников реакции.
всех участников реакции.
 . (47)
. (47)

 = – 16,48 кДж/моль;
= – 16,48 кДж/моль;

 = 0 кДж/моль;
= 0 кДж/моль;

 = 0 кДж/моль.
= 0 кДж/моль.
 = 2·
= 2· 
 –3·
–3· 
 –
– 

 = 2·(– 16,48) = – 32, 96 кДж.
= 2·(– 16,48) = – 32, 96 кДж.
Вариант б) Если известны тепловой эффект реакции и изменение энтропии в ходе реакции, то расчет можно вести по формуле:
 . (48)
. (48)
 = – 91,88 кДж (см. задачу №2),
= – 91,88 кДж (см. задачу №2),
 = – 197,74 Дж/К (см. задачу №10).
= – 197,74 Дж/К (см. задачу №10).
 = – 91880 – 298·(–197,74) = – 32953,5 Дж.
= – 91880 – 298·(–197,74) = – 32953,5 Дж.
Так как  < 0, реакция
< 0, реакция  при 1 атм и температуре Т = 298 К осуществима, т.е. самопроизвольно протекает в прямом направлении.
при 1 атм и температуре Т = 298 К осуществима, т.е. самопроизвольно протекает в прямом направлении.
Задача №14
Вычислите изменение энергии Гиббса (ΔG0) при нагревании 1 моля вещества (при постоянном давлении 1 атм), приведенного в табл. 14, от Т1 до Т2 К.
Таблица 14
| Вариант | Вещество | Т1, К | Т2 , К |
 нитрометан нитрометан
| |||
 нитроэтан нитроэтан
| |||
 этиленгликоль этиленгликоль
| |||
 глицерин глицерин
| |||
 диметиламин диметиламин
| |||
 ацетон ацетон
| |||
 циклогексан циклогексан
| |||
 этилацетат этилацетат
| |||
 пропанол-1 пропанол-1
| |||
 этанол этанол
| |||
 амиловый спирт амиловый спирт
| |||
 муравьиная кислота муравьиная кислота
| |||
 хлороформ хлороформ
| |||
 анилин анилин
| |||
 диэтиловый эфир диэтиловый эфир
|
Продолжение таблицы 14
| Вариант | Вещество | Т1, К | Т2 , К |
 пиридин пиридин
| |||
 валериановая кислота валериановая кислота
| |||
 толуол толуол
| |||
 октан октан
| |||
 муравьиная кислота муравьиная кислота
| |||
 бутанол бутанол
| |||
 хлорметан хлорметан
| |||
 пентан пентан
| |||
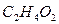 уксусная кислота уксусная кислота
| |||
 нитробензол нитробензол
| |||
 хлорбензол хлорбензол
| |||
 м-ксилол м-ксилол
| |||
 нитроглицерин нитроглицерин
| |||
 1,4-диоксан 1,4-диоксан
| |||
 бензол бензол
|
Решение:
Вычислим ΔG0 при нагревании 1 моля NH3 от T1 = 300 К до T2 = 400 К при постоянном давлении Р = 1 атм.
Вариант а) Изменение свободной энергии Гиббса в процессе нагревания вещества может быть определено из соотношения
 = —S. (49)
= —S. (49)
При p = const
dG = —SdT,
 . (50)
. (50)
Расчет можно вести с различной степенью точности.
Вариант а) Приближенный расчет, без учета зависимости энтропии от температуры проводится по уравнению
 , (51)
, (51)
которое получается после интегрирования уравнения (50) при условии S = const.
По справочным данным абсолютная энтропия аммиака при 298 К  = 192,66 Дж/моль·К.
= 192,66 Дж/моль·К.
 – 192,66·(400 – 300) = – 19266 Дж.
– 192,66·(400 – 300) = – 19266 Дж.
Вариант б) Более точный расчет можно провести, учитывая, что энтропия зависит от температуры. Для этого необходимо вывести уравнение зависимости S = f(T). Учтем, что
 . (52)
. (52)
Если пренебречь зависимостью теплоемкости от температуры и проинтегрировать уравнение (52), считая  = const, тогда получим
= const, тогда получим
 .
.
Тогда из уравнения (50)
DG0 = –  ,
,
 ,
,
DG0 = – (  (T2 – T1) +
(T2 – T1) +  T2 lnT2 –
T2 lnT2 –  T1 lnT1 –
T1 lnT1 –  (T2 – T1) –
(T2 – T1) –
–  T2 ln298 +
T2 ln298 +  T1 ln298) = – ((
T1 ln298) = – ((  -
-  ) (T2 – T1) +
) (T2 – T1) +
+  T2 (lnT2 – ln298)+
T2 (lnT2 – ln298)+  T1 (ln298 – lnT1),
T1 (ln298 – lnT1),
DG0 = (  –
–  )(T2 – T1) –
)(T2 – T1) –  (T2 ln
(T2 ln  T1 ln
T1 ln  ). (53)
). (53)
Полученной формулой можно пользоваться для приближенного подсчета  в небольшом интервале температур при условии
в небольшом интервале температур при условии  = const.
= const.
По справочным данным средняя теплоемкость аммиака в данном интервале температур  = 35,16 Дж/(моль·К), абсолютная энтропия аммиака при 298 К
= 35,16 Дж/(моль·К), абсолютная энтропия аммиака при 298 К  = 192,66 Дж/(моль·К).
= 192,66 Дж/(моль·К).
 = (35,16 – 192,66)(400 – 300) – 35,16·400·ln
= (35,16 – 192,66)(400 – 300) – 35,16·400·ln  +
+
+ 35,16·300·ln  = – 19796 Дж.
= – 19796 Дж.
Вариант в) Точный расчет, с учетом того, что теплоемкость является функцией температуры.
По справочным данным зависимость теплоемкости аммиака от температуры выражается уравнением:
Ср NH3 = 29,80 + 25,48·10–3 T – 1,67·105/ T2.
Выведем зависимость энтропии от температуры с учетом зависимости теплоемкости от температуры:
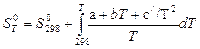 =
=  =
=
=  + a.lnT/298 + b(T – 298) – с//(2.Т2) + с//(2.2982).
+ a.lnT/298 + b(T – 298) – с//(2.Т2) + с//(2.2982).
Подставляя справочные данные, получим уравнение
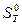 = 192,66 + 29,80 ln T – 29,80 ln298 + 25,48·10–3 T –
= 192,66 + 29,80 ln T – 29,80 ln298 + 25,48·10–3 T –
– 25,48·10–3·298 + 1,67·105/(2· Т 2) –1,67.105/(2.2982);
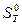 = 14,12 + 29,80 ln T + 25,48·10–3 T + 0,835·105/ Т 2.
= 14,12 + 29,80 ln T + 25,48·10–3 T + 0,835·105/ Т 2.
Подставим полученное уравнение в формулу для расчета функции энергии Гиббса (50):
 = –
= –  (14,12 + 29,80 ln T + 25,48·10–3 T + 0,835·105/ Т 2)dT,
(14,12 + 29,80 ln T + 25,48·10–3 T + 0,835·105/ Т 2)dT,
 = – (14,12 T + 29,80· T ·ln T – 29,80 T + 25,48/2·10–3 T 2 –
= – (14,12 T + 29,80· T ·ln T – 29,80 T + 25,48/2·10–3 T 2 –
– 0,835·105/ Т)  ,
,
 = – (14,12(400 – 300) + 29,80·400·ln400 – 29,80·300·ln 300 –
= – (14,12(400 – 300) + 29,80·400·ln400 – 29,80·300·ln 300 –
– 29,80(400 – 300) + 12,74·10–3 (4002 – 3002) – 0,835·105(1/400 –
– 1/300)) = – 19819 Дж.
Вариант г) Расчет с использованием приведенных функции энергии Гиббса
 , (54)
, (54)
 , (55)
, (55)
 ,(56)
,(56)
 = 400 · DФ400 + DН00 – 300 · DФ300 – DН00 = 400 · DФ400 – 300 · DФ300.
= 400 · DФ400 + DН00 – 300 · DФ300 – DН00 = 400 · DФ400 – 300 · DФ300.
В справочнике отсутствует значение Ф400, найдем его путем интерполирования:
Ф298 = – 158,98 Дж/(моль·К), Ф500 = – 176,82 Дж/(моль·К)

Ф400 = –158,98 –8,92 = – 167,9 Дж/(моль∙К).
 = 400·(–167,9) – 300·(–158,98) = – 19466 Дж.
= 400·(–167,9) – 300·(–158,98) = – 19466 Дж.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 1494; Нарушение авторских прав?; Мы поможем в написании вашей работы!