
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние внешних условий на равновесное состояние
Тема 4. Химическое равновесие.
Задача №15
Запишите выражения для констант равновесия KC, Kр и KN и установите связь между ними для реакции, приведенной в табл. 2.
Решение:
Решение задачи рассмотрим на примере реакции 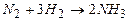 , считая реагирующие вещества идеальными газами.
, считая реагирующие вещества идеальными газами.
В условиях равновесия при р, T = const схематическая запись химической реакции имеет вид:
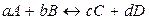 ,
,
где a, b, c, d – стехиометрические коэффициенты веществ A, B, C, D. Для рассматриваемой реакции закон действующих масс устанавливает постоянство отношения произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам, то есть
 .
.
На основании закона действующих масс запишем выражение для константы равновесия KC для реакции синтеза аммиака.
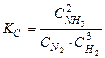 .
.
Аналогичным образом записываются формулы для констант равновесия, выраженных через равновесные парциальные давления:
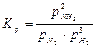
и равновесные мольные доли:
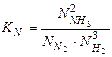 .
.
Связь между Kр и KC устанавливается на основании уравнения (9). Для i-го компонента газовой смеси  , отсюда:
, отсюда:  . На основании данного выражения
. На основании данного выражения
 .
.
Для реакции синтеза аммиака Dn = (2) – (1 + 3) = – 2. Следовательно,
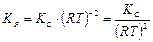 .
.
Связь между Kр и KN устанавливается на основании закона Дальтона:  , где р – общее давление в системе. Оперируя данным выражением, получим
, где р – общее давление в системе. Оперируя данным выражением, получим
 .
.
Необходимо отметить, что при расчете констант всегда используется безразмерное относительное давление, равное отношению давления к стандартному значению р о = 1 атм = 1,01325∙105 Па.
Задача №16
Для реакции, приведенной в табл. 2, рассчитайте константы равновесия Kр, KC и KN при 298 К и общем давлении р Па (табл.15). Выразите константу равновесия Kр через состав равновесной смеси, если для проведения реакции исходные вещества взяты в стехиометрическом соотношении.
Таблица 15
| Вариант | р ·10–6, Па | Вариант | р ·10–6, Па |
| 9,73 | 9,76 | ||
| 9,74 | 9,78 | ||
| 9,75 | 9,79 | ||
| 9,73 | 9,73 | ||
| 9,73 | 9,73 | ||
| 9,73 | 9,79 | ||
| 9,74 | 9,74 | ||
| 9,77 | 9,75 | ||
| 9,78 | 9,73 | ||
| 9,73 | 9,71 | ||
| 9,77 | 9,77 | ||
| 9,77 | 9,75 | ||
| 9,78 | 9,78 | ||
| 9,79 | 9,77 | ||
| 9,76 | 9,76 |
Решение:
Решение задачи рассмотрим на примере реакции  . Рассчитаем константы равновесия KN, KC и Kр при Т = 298 К и общем давлении 9,73·106Па, если для проведения реакции исходные вещества взяты в стехиометрическом соотношении (1 моль N2 и 3 моль H2).
. Рассчитаем константы равновесия KN, KC и Kр при Т = 298 К и общем давлении 9,73·106Па, если для проведения реакции исходные вещества взяты в стехиометрическом соотношении (1 моль N2 и 3 моль H2).
Значение константы равновесия при температуре 298 К найдем из соотношения
 .
.
Отсюда
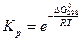 .
.
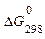 = –32953,5 Дж (см. задачу №13).
= –32953,5 Дж (см. задачу №13).
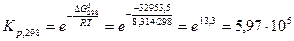 .
.
Соотношения между KC, Kр и KN выведены в задаче 15:
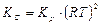 ,
,

где р – относительное давление, т.е. давление, отнесенное к стандартному: р = 9,73·106 / 1,01325∙105 = 96.
 ,
,
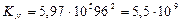 .
.
Для расчета состава равновесной смеси определим количество молей в состоянии равновесия.
Обозначим через х число молей NH3 в момент равновесия. На основании стехиометрии реакции, если образовалось две молекулы NH3, то израсходована одна молекула азота и три молекулы водорода. Таким образом, если образовалось х молей NH3, то израсходовано  молей N2 и
молей N2 и  молей H2. По условию задачи для проведения реакции взяты 1 моль N2 и 3 моль H2. Следовательно, к моменту равновесия в реакционной смеси осталось
молей H2. По условию задачи для проведения реакции взяты 1 моль N2 и 3 моль H2. Следовательно, к моменту равновесия в реакционной смеси осталось 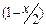 молей N2 и
молей N2 и 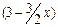 молей H2 .
молей H2 .
Рассчитаем общее число молей компонентов реакции в момент равновесия
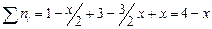 .
.
Определим мольную долю каждого компонента реакции при равновесии по формуле (41). Определим также равновесное парциальное давление компонентов на основании закона Дальтона (табл.16).
Таблица 16
| Вещество | N2 | H2 | NH3 | |
| Число молей | В начале реакции | y | 3y | – |
| В момент равновесия | 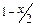
| 
| 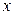
| |
| Мольная доля компонента | 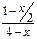
| 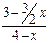
| 
| |
| Равновесное парциальное давление | 
| 
| 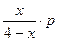
|
Выражение для константы равновесия имеет вид:

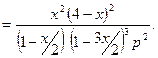
Задача №17
Рассчитайте при температуре Т К (табл. 6) изменение энергии Гиббса DG0 для реакции, приведенной в табл. 2.
Решение:
Вычислим DG0 при 800 К для реакции 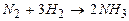 .
.
Вариант а) Приближенный расчет, в котором принимается энтропия реакции постоянной и не учитывается изменение теплоемкости реакции от температуры (т.е. 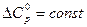 ). Такое приближенное решение необходимо для быстрой оценки возможности реакции при интересующей нас температуре.
). Такое приближенное решение необходимо для быстрой оценки возможности реакции при интересующей нас температуре.
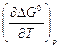 = – ΔS0298,
= – ΔS0298,
Расчет ΔS0298, реакции показан в задаче №10. ΔS0298, реакции = – 197,74 Дж/К.
Разделим переменные и проинтегрируем:
dDG0 = ΔS0298 dT,
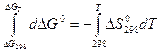 ,
,
DGT0 = ΔG0298 – ΔS0298 (T – 298). (57)
Величину изменении энергии Гиббса для данной реакции при Т = 298 К ΔG0298, реакции рассчитываем по справочным данным (см. задачу №13): ΔG0298, реакции = – 32960 Дж.
 = – 32960 – (–197,74)·(800 – 298) = 66305,5 Дж.
= – 32960 – (–197,74)·(800 – 298) = 66305,5 Дж.
Вариант б) Точный расчет производим по формуле
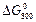 =
= 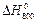 – 800·
– 800·  , (58)
, (58)
последовательно рассчитав точные значения изменения энтропии и теплового эффекта реакции, с учетом зависимости теплоемкостей участников реакции от температуры (т.е. 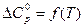 ) (см. задачи №8 и №10):
) (см. задачи №8 и №10):
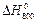 = – 107815 Дж
= – 107815 Дж
 = – 230,36 Дж/K.
= – 230,36 Дж/K.
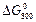 = – 107815 – 800·(–230,36) = 76473 Дж.
= – 107815 – 800·(–230,36) = 76473 Дж.
Вариант в) Точный расчет по методу Шварцмана–Темкина с учетом зависимости изменения теплоемкости реакции от температуры производят по уравнению:
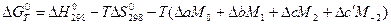 . (59).
. (59).
Вычисления по данному уравнению исключают интегрирование и сводятся к умножению и сложению.
В данном уравнении 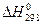 – стандартный тепловой эффект реакции при температуре 298 К,
– стандартный тепловой эффект реакции при температуре 298 К, 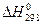 = – 91880 Дж (см. задачу №2);
= – 91880 Дж (см. задачу №2);  – изменение энтропии в ходе реакции при температуре 298 К,
– изменение энтропии в ходе реакции при температуре 298 К,  = – 197,74 Дж/К (см. задачу № 10);
= – 197,74 Дж/К (см. задачу № 10); 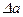 ,
,  и др. –коэффициенты уравнения
и др. –коэффициенты уравнения 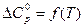 . Их значения рассчитаны в задаче №7:
. Их значения рассчитаны в задаче №7:
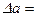 –50,12;
–50,12;
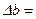 36,91·10–3;
36,91·10–3;
 –3,34·105;
–3,34·105;
 –1,15·10–6.
–1,15·10–6.
Коэффициенты 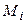 при необходимой температуре Т определяем по справочнику. Для температуры 800 К:
при необходимой температуре Т определяем по справочнику. Для температуры 800 К:
 ,
,
 ,
,
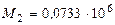 ,
,
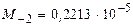 .
.
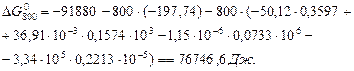
Во всех трех вариантах расчета значение 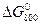 оказалось положительным в отличие от
оказалось положительным в отличие от 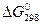 , т.е. повышение температуры неблагоприятно для протекания реакции в прямом направлении, при температуре Т = 800 К самопроизвольный процесс идет от продуктов реакции к исходным веществам.
, т.е. повышение температуры неблагоприятно для протекания реакции в прямом направлении, при температуре Т = 800 К самопроизвольный процесс идет от продуктов реакции к исходным веществам.
Задача №18
Рассчитайте константу равновесия 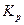 для реакции, приведенной в табл. 2, при 298 К и температуре Т К (табл. 6).
для реакции, приведенной в табл. 2, при 298 К и температуре Т К (табл. 6).
Решение:
Решение задачи рассмотрим на примере реакции образования аммиака  . Найдем константу равновесия при температурах 298 К и 800 К.
. Найдем константу равновесия при температурах 298 К и 800 К.
Значение константы равновесия при температуре 298 К найдем из соотношения
 . (60)
. (60)
Отсюда
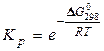 .
.
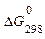 = –32953,5 Дж (см. задачу №13).
= –32953,5 Дж (см. задачу №13).
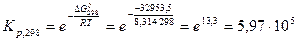 .
.
Расчет константы равновесия при температуре, отличной от стандартной, можно произвести с различной степенью точности.
Вариант а) Приближенный расчет. Значение константы равновесия при температуре Т можно найти, воспользовавшись уравнением изобары Вант-Гоффа:
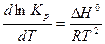 (61)
(61)
Считая тепловой эффект реакции 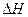 постоянным в интервале температур от Т1 до Т2.
постоянным в интервале температур от Т1 до Т2.  =
= 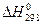 = – 91880 Дж (см. задачу №2).
= – 91880 Дж (см. задачу №2).
 . (62)
. (62)
После интегрирования уравнения (62) получаем следующее выражение:
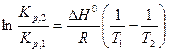 ,
,
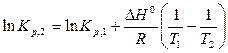 ,
,
Если Т1 = 298, то 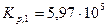 .
.
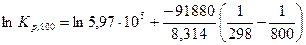 ,
,
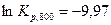 .
.
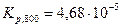 .
.
Вариант б) Более точный расчет должен учитывать зависимость теплового эффекта реакции от температуры. Эту зависимость можно вывести также с разной степенью точности.
При условии, что теплоемкость не зависит от температуры (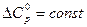 )
)  Дж/К (см. задачу №8) получаем уравнение:
Дж/К (см. задачу №8) получаем уравнение:
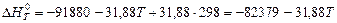 .
.
Подставим полученную зависимость в уравнение изобары Вант–Гоффа:
 ,
,
 ,
,
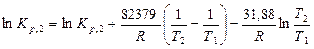
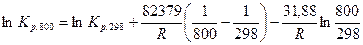 ,
,
 ;
;
 .
.
Вариант в) Точный расчет. Расчет будет точным, если при выводе уравнения зависимости теплового эффекта реакции от температуры учитывать зависимости теплоемкостей участвующих в реакции веществ от температуры, т.е. учитывать уравнение 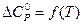 :
:
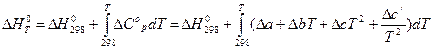 .
.
По данным задачи №8 уравнение 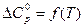 для реакции образования аммиака имеет вид:
для реакции образования аммиака имеет вид:
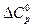 = –50,12 + 36,91·10–3Т – 3,34·105/Т2 + 1,50·10--6Т2.
= –50,12 + 36,91·10–3Т – 3,34·105/Т2 + 1,50·10--6Т2.
Зависимость теплового эффекта этой реакции от температуры:
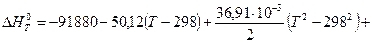
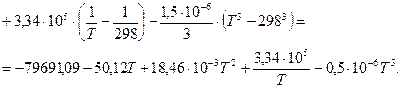
После подстановки этой зависимости в уравнение изобары Вант–Гоффа, получим

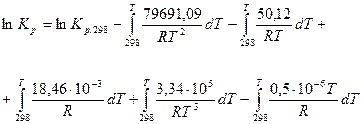
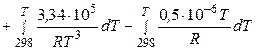 ,
,
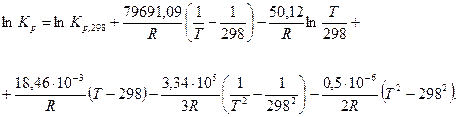
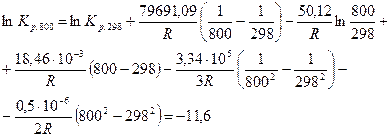
 .
.
Вариант г) Точный расчет. Константа равновесия реакции образования аммиака при температуре 800 К может быть точно рассчитана по значению изменения энергии Гиббса, которое вычислено с учетом влияния температуры на 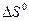 ,
,  и
и 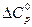 реакции (см. задачу №17):
реакции (см. задачу №17): 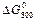 = 76746,6 Дж.
= 76746,6 Дж.
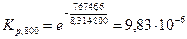 .
.
Задача №19
Определить направление реакции, приведенной в табл. 2, при температуре Т К (табл. 6) и общем давлении р Па, если число молей неравновесной смеси 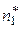 ,
, 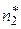 (исходные вещества),
(исходные вещества),  ,
, 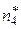 (продукты реакции) даны в табл. 17. Значение константы равновесия при температуре Т взять из задачи №17.
(продукты реакции) даны в табл. 17. Значение константы равновесия при температуре Т взять из задачи №17.
Таблица 17
| Вариант | 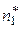
| 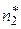
| 
| 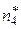
| р ·10–6 , Па |
| 0,5 | 0,2 | 0,3 | – | 9,73 | |
| 0,5 | 0,1 | 0,5 | 0,1 | 9,74 | |
| 0,5 | – | 0,5 | – | 9,75 | |
| 0,25 | 0,25 | 0,25 | 0,25 | 9,73 | |
| 0,3 | 0,2 | 0,2 | 0,3 | 9,73 | |
| 0,25 | 0,35 | 0,15 | 0,25 | 9,73 | |
| 0,6 | – | 0,2 | 0,2 | 9,74 | |
| 0,25 | 0,4 | 0,25 | 0,1 | 9,77 | |
| 0,35 | 0,3 | 0,25 | 0,1 | 9,78 | |
| 0,1 | 0,6 | 0,15 | 0,15 | 9,73 | |
| 0,325 | – | 0,325 | 0,35 | 9,77 | |
| 0,4 | – | 0,3 | 0,3 | 9,77 | |
| 0,3 | 0,3 | 0,4 | – | 9,78 | |
| 0,15 | 0,7 | – | 9,79 | ||
| 0,15 | 0,15 | 0,35 | 0,35 | 9,76 | |
| 0,25 | 0,25 | 0,25 | 0,25 | 9,76 | |
| 0,5 | – | 0,15 | 0,35 | 9,78 | |
| 0,35 | 0,5 | 0,15 | – | 9,79 | |
| 0,5 | 0,4 | 0,1 | – | 9,73 | |
| 0,3 | 0,2 | 0,2 | 0,3 | 9,73 | |
| 0,2 | 0,2 | 0,6 | – | 9,79 | |
| 0,55 | – | 0,15 | 0,3 | 9,74 | |
| 0,35 | 0,55 | 0,1 | – | 9,75 | |
| 0,4 | – | 0,4 | 0,2 | 9,73 | |
| 0,25 | 0,4 | 0,25 | 0,1 | 9,71 | |
| 0,8 | 0,15 | 0,15 | - | 9,77 | |
| 0,3 | – | 0,3 | 0,4 | 9,75 | |
| 0,1 | 0,6 | 0,15 | 0,15 | 9,78 | |
| 0,25 | – | 0,25 | 0,5 | 9,77 | |
| 0,15 | 0,15 | 0,35 | 0,35 | 9,76 |
Решение:
Решение задачи рассмотрим на примере реакции образования аммиака  . Определим направление данной реакции при температуре Т = 800 К и общем давлении р = 9,73·106 Па, если число молей компонентов реакции в исходной неравновесной смеси составило
. Определим направление данной реакции при температуре Т = 800 К и общем давлении р = 9,73·106 Па, если число молей компонентов реакции в исходной неравновесной смеси составило 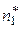 = 0,5;
= 0,5; 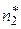 = 0,3;
= 0,3;  = 0,2. Значение константы равновесия
= 0,2. Значение константы равновесия  (см. задачу № 17).
(см. задачу № 17).
Установим знак величины 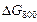 . Воспользуемся уравнением изотермы Вант–Гоффа:
. Воспользуемся уравнением изотермы Вант–Гоффа:
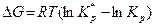 , (63),
, (63),
где 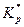 – величина, рассчитываемая по той же формуле, что и
– величина, рассчитываемая по той же формуле, что и  , но для неравновесных условий, как отношение неравновесных парциальных давлений компонентов реакции (
, но для неравновесных условий, как отношение неравновесных парциальных давлений компонентов реакции (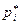 )
)
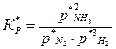 .
.
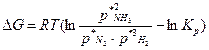 .
.
При анализе уравнения изотермы Вант–Гоффа следует рассмотреть три случая:
1) Если 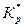 >
>  , то
, то 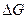 > 0, т.е. реакция идет в обратном направлении в сторону образования исходных веществ.
> 0, т.е. реакция идет в обратном направлении в сторону образования исходных веществ.
2) Если 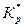 <
<  , то
, то 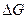 < 0, т.е. реакция идет самопроизвольно в прямом направлении в сторону образования продуктов реакции.
< 0, т.е. реакция идет самопроизвольно в прямом направлении в сторону образования продуктов реакции.
3) Если 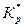 =
=  , то
, то 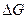 = 0, т.е. система находится в равновесии.
= 0, т.е. система находится в равновесии.
Рассчитаем величину 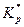 через
через 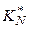 – константу, выраженную через мольные доли компонентов в неравновесной исходной смеси.
– константу, выраженную через мольные доли компонентов в неравновесной исходной смеси.
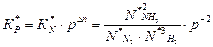 .
.
Для этого рассчитаем величины мольных долей компонентов неравновесной смеси  с использованием формулы
с использованием формулы 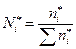 .
.
Общее число молей неравновесной смеси
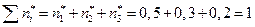 .
.
Мольные доли компонентов в данном случае:
 ;
; 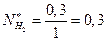 ;
; 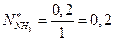
численно равны числу молей этих компонентов в системе.
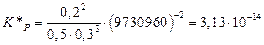 .
.
Так как 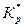 <
<  , то выполняется условие (2), следовательно, реакция будет протекать самопроизвольно в прямом направлении. Подтвердим полученные данные расчетом
, то выполняется условие (2), следовательно, реакция будет протекать самопроизвольно в прямом направлении. Подтвердим полученные данные расчетом 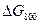 :
:
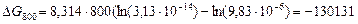 Дж/моль.
Дж/моль.
Задача №20
Оцените влияние температуры и давления на константу равновесия реакции, приведенной в табл. 2. Тепловой эффект реакции взять из решения задачи №2.
Решение:
Решение задачи рассмотрим на примере реакции синтеза аммиака  .
.
а) Для оценки влияния температуры воспользуемся уравнением изобары Вант–Гоффа (61).
Анализ уравнения изобары Вант-Гоффа показывает, что характер зависимости константы равновесия 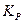 от температуры определяется знаком теплового эффекта
от температуры определяется знаком теплового эффекта 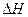 . Возможны 3 случая:
. Возможны 3 случая:
1) 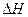 > 0 – для эндотермических реакций, т.е. реакций, протекающих с поглощением теплоты. Отсюда
> 0 – для эндотермических реакций, т.е. реакций, протекающих с поглощением теплоты. Отсюда  , зависимость константы равновесия от температуры будет возрастающей, т.е. с ростом температуры константа равновесия
, зависимость константы равновесия от температуры будет возрастающей, т.е. с ростом температуры константа равновесия  будет увеличиваться.
будет увеличиваться.
2) 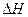 < 0 – для экзотермических реакций, т.е. реакций, протекающих с выделением теплоты. Отсюда
< 0 – для экзотермических реакций, т.е. реакций, протекающих с выделением теплоты. Отсюда 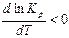 , зависимость константы равновесия от температуры будет убывающей, т.е. с ростом температуры константа равновесия
, зависимость константы равновесия от температуры будет убывающей, т.е. с ростом температуры константа равновесия 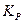 будет уменьшаться.
будет уменьшаться.
3) Если 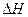 » 0, то
» 0, то 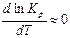 , следовательно, константа равновесия от температуры не зависит.
, следовательно, константа равновесия от температуры не зависит.
Для рассматриваемой реакции 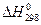 = –91,88 кДж, т.е. реакция является экзотермической, следовательно, выполняется условие (2). Поэтому с ростом температуры константа равновесия будет уменьшаться. Это согласуется с величинами констант равновесия при температурах Т = 298 К и Т = 800 К (см. решение задачи № 18).
= –91,88 кДж, т.е. реакция является экзотермической, следовательно, выполняется условие (2). Поэтому с ростом температуры константа равновесия будет уменьшаться. Это согласуется с величинами констант равновесия при температурах Т = 298 К и Т = 800 К (см. решение задачи № 18).
б) Для оценки влияния давления воспользуемся уравнением Планка:
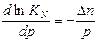 , (64),
, (64),
где  – изменение числа молей газообразных веществ в ходе реакции. Проанализируем уравнение Планка:
– изменение числа молей газообразных веществ в ходе реакции. Проанализируем уравнение Планка:
1) Если реакция идет с увеличением числа молей газообразных веществ,  , то
, то  , т.е. с ростом давления константа равновесия
, т.е. с ростом давления константа равновесия 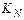 уменьшается.
уменьшается.
|
|
Дата добавления: 2017-02-01; Просмотров: 68; Нарушение авторских прав?; Мы поможем в написании вашей работы!