
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Можна показати, що 2 страница
|
|
|
|
3. на невеликих відстанях між молекулами діють як сили притягання так, і сили відштовхування; природа цих сил -електромагнітна.
2. Маса і розмір молекул і атомів.
Молекула складається з атомів. Атом складається з ядра та електронів, що обертаються навколо нього по орбітах. Ядро атома складається з нуклонів, тобто протонів та нейтронів. Всі
Властивості речовини залежать від внутрішнього розміщення а гомін.
Наприклад: графіт і алмаз складаються з атомів вуглецю, але мають різну міцність.
В залежності від видів атомів та їх розміщення, речовини можуть знаходитись у агрегатних етапах: твердому, рідкому та газоподібному. Якщо молекула розпадається на атоми, то змінюються хімічні та фізичні властивості речовини. Приклад: вода - рідина, водень та кисень з яких складається вода - гази.
Речовини які не можна розкласти на більш прості частинки називаються хімічними елементами.
Рух молекул пояснює, явище дифузії взаємне проникнення молекул однієї речовини у іншу речовину (вирівнювання концентрації молекул речовин у просторі).
Процес односторонньої дифузії однієї рідини (розчинника) в іншу (розчин) через напівпрозору перегородку називається осмос. Наприклад, якщо на межі розділу води і розчину мідного купоросу помістити целофанову перегородку, то через неї буде дифундувати тільки вода.
Швидкість дифузії в різних станах речовин різна: найшвидше проходить у газах, найповільніше у твердих тілах.
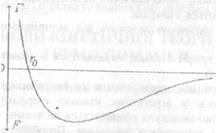
|
Атоми складаються з позитивно зарядженого ядра та негативно заряджених електронів: Властивість однойменних зарядів відштовхуватись, а різнойменних притягуватись пояснює виникнення сил притягання та відштовхування між молекулами залежно від відстані між ними. Цю залежність подано на графіку:
у
З явища дифузії видно, що для газоподібних тіл характерною особливістю є те, що між молекулами практично відсутні сиди взаємного притягання. Вони виникають лише короткочасно при зіткненнях.
Тільки електронні мікроскопи дають обриси деяких великих молекул. Для визначення діаметру молекули можна вилити на поверхню води краплю олії, яка розтечеться й утворить тоненьку плівку товщиною з діаметр однієї молекули. Якщо знаємо об'єм каплі та площу поверхні плівки, то діаметр молекули олії приблизно оцінюють з формули D= V/S. Розміри молекул мають порядок =10 -10м
Розміри молекул можна уявити в порівнянні: розміри молекули менші від яблука так, як розміри яблука менші від розмірів Землі.
Маси молекул також дуже малі: для кисню для водню і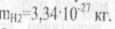
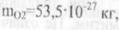
На практиці вимірювати ці маси в кілограмах не зручно, тому використовуються атомні одиниці мас
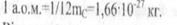
Відносна молекулярна (атомна) маса Мг - це відношення маси молекулн(або атома) речовини до 1/12 маси атома вуглецю:
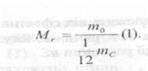
Через велику кількість молекул в одиниці об'єму при розрахунках користуються порціями (певною кількістю) молекул. За одиницю вимірювання такої порції прийнято 1 моль кількість молекул, що міститься у 12г вуглецю. Для будь-якої речовини в 1 молі міститься 6,02 ·10 23молекул, що і є числом Авогадр о.
Кіль кість ре човини V півиа відношенню загальної кількості молекул до числа Авогадро:, де N - всього молекул у

речовині,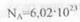 моль-1 - число Авогадро.
моль-1 - число Авогадро.
Масу одного моля речовини називають молярною масою М:
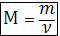
ν – кількість речовини (моль)
m – маса речовини (кг)
Кількість молекул речовини в 1 м називається концентрацією речовини
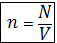
3. Броуновський рух. Дослід Штерна.Температура та її вимірювання.
При нагріванні тіл зростає швидкість руху молекул, що підтверджується явищем дифузії. Ступінь нагрітості тіла характеризує його температура Т.
В побутових умовах її вимірюють за шкалою Цельсія у градусах ([1]=°С), де за 00 С прийнята температура танення льоду, а за 1000С температура кипіння води за нормального тиску (760 мм.мр.ст.)Температуру вимірюють: рідинними та твердими термометрами, термопарою. Дія термометрів грунтується на явищах, що залежать від температури: теплове розширення тіл, зміна тиску газу, електричного опору речовин, об'єму речовин.
Безперервний хаотичний рух молекул називають тепловим рухом. Цей рух є складним, адже складається з рухів великої кількості частинок, траєкторії яких складні ламані лінії.
Оскільки молекули рухаються з певними швидкостями і взаємодіють, то вони мають кінетичну і потенціальну енергію. Сума кінетичної та потенціальної енергії всіх частинок тіла називається внутрішня енергія тіл а.
Одним з підтверджень хаотичності руху молекул є броунівський рух, тобто рух пилинок, обумовлений ударами по них молекулами навколишньої рідини або тазу.
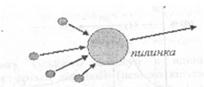
Чим більша пилинка, тим менше вона змінює свою швидкість (властивість інертності).
Швидкість руху молекул можна виміряти на досліді Штерна.
При проходженні електричного струму через платиновий посріблений дріт О, він нагрівається і молекули срібла випаровуються з поверхні дроту.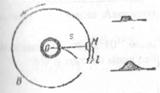 Більшість з них осідає на стінках циліндра А.
Більшість з них осідає на стінках циліндра А.
Лише частина пролітає через
розріз у циліндрі, та потрапляє на циліндр II в точці М. Якщо циліндри обертаються, то ці молекули потраплять в точку К. В дослідах Штерна була отримана швидкість близько 500 м/с.
Абсолютна температура - це величина, яка характеризує термодинамiчну рiвновагу системи.
Лекція ХІІ
ТЕМА: МОЛЕКУЛЯРНА ФІЗИКА.
ПЛАН
1. Основне рівняння МКТ.
2. Рівняння Клапейрона – Медєлєєва.
1. Найпростіший об'єкт дослідження у молекулярній фізиці - ідеальний газ.
Iдеальний газ - це газ, молекули якого можна вважати матеріальними точками, та можна знехтувати взаємодiєю мiж його молекулами.
Знайдемо рiвняння, яке б зв'язувало залежнiсть параметрiв стану газу з кiнетичною енергiєю поступалього руху його молекул.
Із найбільш загальних мiркувань тиск визначається наслiдком ударiв молекул об стiнку посудини з деякою силою, величина якої невiдома.
Уведемо середню кiнетичну енергiю поступального руху однiєї молекули газ у:
у:
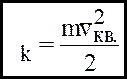 (*)
(*)
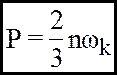 (1)
(1)
- основне рiвняння МКТ.
Р – тиск (Па)
n – концентрація (м-3)
ωк – кінетична енергія молекули (Дж)
Тиск в ідеальному газовi дорiвнюї 2/3 добутку середньокiнетичної енергiї поступального руху молекули газу на концентрацiю молекул газу.
Це рівняння основне тому, що пов`язує макропараметри з мікрохарактеристиками газу (швидкість однієї молекули).
Воно дає відповідь на питання, чому в газі є тиск. Тому, що молекули володіють кінетичною енергією, б’ють із силою на грані куба і зумовлюють тиск.
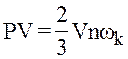
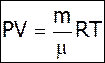 - Рівняння Клапейрона Мендлєєва
- Рівняння Клапейрона Мендлєєва
V- об’єм (м3)
m – маса (кг)
μ – молярна маса (кг/ моль)
R – універсальна газова стала = 8, 31 Дж/ моль ·К
Т – температура (К)
Тому рівняння Клапейрона-Менделєєва є звичайним наслідком основного рівняння молекулярної теорії.
Ми знайшли, що
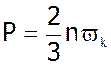 ;
; 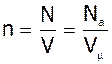 ,
,
де 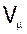 - об`єм одного моля газу;
- об`єм одного моля газу;
Nа - стала Авогадро; 6.023 10 23 моль-1 - величина, яка показує кількість молекул, що знаходяться в одному молі газу.
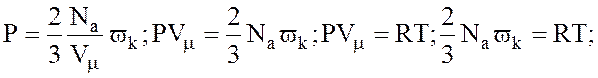
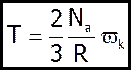 (2)
(2)
Температура є мірою 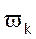 поступального руху молекул газу.
поступального руху молекул газу.
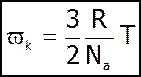
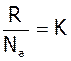 - стала Больцмана; К=1.38*10-23 Дж/К.
- стала Больцмана; К=1.38*10-23 Дж/К.
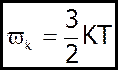 (3)
(3)
- кінетична енергія поступального руху однієї молекули.
Порівнявши (3) і (*), будемо мати:
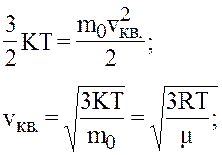
Другий варіант формули одержимо з урахуванням:
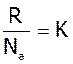 та
та 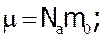
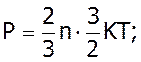
 (4)
(4)
Цей вираз є одним із варіантів запису основного рівняння МКТ.
Лекція ХІІІ
ТЕМА: МОЛЕКУЛЯРНА ФІЗИКА.
ПЛАН
1. Ізопроцеси.
2. Газові закони.
1. Процеси при яких маса газу і один з термодинамічних параметрів залишаються постійними називаються ізопроцесами.
2. Газові закони
| Назва ізопроцесу та газовий закон, що характеризує цей ізороцес | Постійні параметри | Формула | Графік | |||
| Ізотермічний Закон Бойля - Маріотта | Т =const РV= const | Р1V1 = Р2V2 |  
 Р
Т2 Р
Т2
 Т1
V Т1
V
| |||
| Ізобарний Закон Гей - Люссака | Р= const
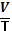 = const = const
| 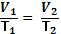
| 
 V Р2 V Р2
 Р2 Р2
Т
| |||
| Ізохорний Закон Шарля | V = const
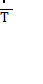 = const = const
| 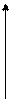
 Р V2 Р V2
 V1 V1
Т
|
Лекція ХІV
ТЕМА: ВЛАСТИВОСТІ РЕЧОВИН
В РІЗНИХ АГРЕГАТНИХ СТАНАХ
ПЛАН
1 Пароутворення і конденсація. Види пароутворення.
2.Від чого залежить швидкість випаровування.
3. Насичена і неиасичена пара. Критична температура.
4. Кипіння рідини. Температура кипіння.
5. Вологість повітря.
Речовина може знаходитись у агрегатних станах: твердий, рідкий та газоподібний.
Перехід речовини з рідкого стану у газоподібний називається Ш роут воре нням.
Перехід речовини з газоподібного етапу у рідкий називається конденсація.
Пароутворення є двох видів - випаровування та кипіння.
Вип аро вування - це утворення пару з поверхні рідини.
Його інтенсивність залежить від
1.Температури;
2.Роду рідини;
3. Площі поверхні рідини;
4.Вітру над рідиною.
При випаровуванні знижується температура рідини, оскільки її залишають молекули з найбільшою кінетичною енергією.
Якщо випаровування відбувається у закритій посудині, то настане момент коли кількість молекул, що випарувалось зрівнюється з кількістю молекул, що конденсувались.
Пара у якій швидкість випаровування рівна швидкості конденсації називається насиченою. Така пара знаходиться у динамічній рівновазі зі своєю рідиною.
Тиск насиченої пари при постійній температурі не міняється та не залежить від об'єму, оскільки концентрація молекул такого пару не змінюється. Для насиченої пари закони ідеального тазу не застосовуються оскільки при зміні термопарамегрів змінюється маса газу. І при збільшені температури тиск - збільшується.
Якщо в закритій посудині нагрівати рідину з насиченою парою то густина рідини зменшуватиметься, а пари збільшуватиметься. Температуру при якій зникають фізичні відмінності між рідиною і парою називають к ритичною.
Пара є н енасиченою, якщо швидкість випаровування більша від конденсації.
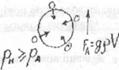
Кипіння - це утворення пари по всьому об'єму рідини при постійній температурі.
|
В середині рідини завжди є пилинки до яких прилипають молекули повітря. Під час нагрівання ці молекули інтенсивніше рухаються та займають більший об'єм (з'являються біля стінок бульбашки повітря куди випаровується рідина). При подальшому нагріванні у середину цих бульбашок випаровується все більше рідини, тому вони
ростуть в об'ємі, а разом з тим сила Архімеда, що діє на них.
 Температура кипіння - це температура при якій тиск насиченої пари рівний або більше зовпішньому(атмосферному) тиску. Чим менший атмосферний тиск, тим менша температура кипіння.
Температура кипіння - це температура при якій тиск насиченої пари рівний або більше зовпішньому(атмосферному) тиску. Чим менший атмосферний тиск, тим менша температура кипіння.
5. Вологість повітря
Оскільки з поверхні океанів, морів та річок відбувається безперервне випаровування, в атмосфері Землі міститься водяна пара.
Величину, що характеризує вміст водяної пари в атмосфері називають вологіс тю по вітря.
ра - це маса водяної пари в 1 м3 повітря.
Одиниці вимірювання ра – (г/ м3)
Абсолютна вологість повітря визначається також через тиск водяної пари, яка міститься в ньому, та вимірюється у міліметрах ртутного стовпчика.
Відносна вологість повітря рівна відношенню відносної вологості повітря ра до густини насиченої пари рн.
 Температура, при якій відносна вологість повітря дорівнює100% називається точкою роси.
Температура, при якій відносна вологість повітря дорівнює100% називається точкою роси.
Способи вимірювання вологості повітря:
1. Психрометром за різницею температур
термометрів, резервуар одного з яких обмотано
смужкою тканини, опущеної у воду (правий), а іншого
залишається сухим (лівий), і за спеціальною таблицею
(психрометричною).
2. Конденсаційним гігрометром - за точкою роси,
тобто температурою, за якої водяна пара, що є в повітрі,
стає насиченою, і за таблицею залежності густини
насиченої водяної пари від температури. Температуру в
камері гігрометра знижують продуванням повітря над
спиртом, внаслідок чого він інтенсивно випаровується.
3. Волосяним гігрометром безпосередньо вимірюють відносну вологість повітря у відсотках.
В основі його роботи лежить властивість зміни довжини волосини при зміні вологості повітря.
Знання відносної вологості повітря дуже важливе для умов зберігання як харчової, так і промислової продукції. Певною мірою вологість впливає на організм сільськогосподарських тварин. В залежності від виду тварин допустимі межі коливання вологості у тваринницьких Приміщеннях становлять в середньому 50-85%.
Лекція ХV
ТЕМА: ВЛАСТИВОСТІ РЕЧОВИН
В РІЗНИХ АГРЕГАТНИХ СТАНАХ
ПЛАН
1. Властивості рідини. Поверхневий натяг.
2.Змочування. Капілярні явища.
1. Розглянемо характер мiжмолекулярної взаємодiї у рiдинi.
 |  | ||||||
 | |||||||
 | |||||||


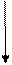




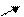
 |  |


 Fp
Fp
 | |||
 |




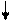
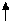
 Fp.= 0
Fp.= 0



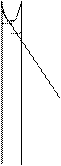
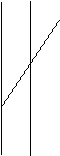
Рiвнодiюча всiх сил, які дiють на молекулу у серединi рiдини, дорiвнює 0. На молекулу в поверхневому шарi дiє рiвнодiюча сила, яка направлена у середину рiдини (оскільки ця молекула взаємодiє з бiльшою кiлькістю молекул у рiдинi та з меншою - над поверхнею).
Тому при переходi молекул із глибини рiдини у поверхневий шар необхiдно витратити роботу проти сил, дiючих у поверхневому шарi.
Унаслiдок цього поверхневий шар рiдини буде мати додаткову енергiю при Т = const. В умовах рівноваги система завжди намагається мати найменшу потенціальну енергію, тому рідина буде приймати форму, відповідну мінімумові потенціальної енергії.
Сили, дiючi на поверхнi рiдини, якi прагнуть зменшити величину її поверхнi, називають силами поверхневого натягу.
Для кiлькiсної оцiнки цих сил уводять поняття коефіцієнта поверхневого натягу 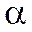 .
.
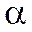 - це величина, яка чисельно дорiвнює вiдношенню роботи
- це величина, яка чисельно дорiвнює вiдношенню роботи 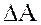 iзотермiчного утворення поверхнi рiдини до площi цiєї поверхнi
iзотермiчного утворення поверхнi рiдини до площi цiєї поверхнi  .
.
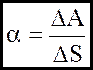 (1)
(1)
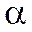 чисельно дорiвнює силi поверхневого натягу F, яка припадає на одиницю граничної лiнiї на поверхнi рiдини
чисельно дорiвнює силi поверхневого натягу F, яка припадає на одиницю граничної лiнiї на поверхнi рiдини
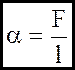 (2)
(2)
l - довжина граничної лiнiї.
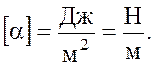
2. У випадкові контакту рiдини з твердим тiлом можуть простежуватися два наслiдки ефекту взаємодiї:
а) змочування;
б) незмочування.
 Hg (ртуть)
Hg (ртуть)
незмочування: 


 Н2О (вода)
Н2О (вода)
 | |||
 |
повне змочування: 
Ефект змочування або незмочування поверхнi твердого тiла рiдиною приводить до викривлення поверхнi рiдини, а будь-яка викривлена поверхня чинить на рiдину додатковий тиск 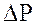 порiвняно з таким у випадкові контакту рiдини з плоскою поверхнею.
порiвняно з таким у випадкові контакту рiдини з плоскою поверхнею.
Кiлькiсну оцiнку величини 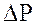 дав Лаплас:
дав Лаплас:
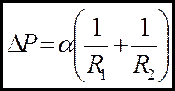 (3)
(3)
- формула Лапласа.
R1, R2 - радiуси кривизни поверхнi у двох взаємно перпендикулярних перерiзах, проведених через одну й ту ж саму точку.
Для сферичної поверхнi R1 = R2:
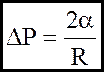
Ефект змочування або незмочування визначає поведiнку рiдини у капiлярах:
змочування приводить до пiднiмання рiдини в капiлярi;
незмочування – до опускання.
 |  | ||||||||||
 | |||||||||||
 |  |  | |||||||||





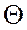
 | |||||||||||||||
 | |||||||||||||||
 | |||||||||||||||
 | |||||||||||||||
 |  | ||||||||||||||
 | |||||||||||||||
 |  | ||||||||||||||









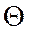
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 420; Нарушение авторских прав?; Мы поможем в написании вашей работы!

